A química do CDS
Composição e aplicações
O dióxido de cloro é um composto inorgânico formado pelo elemento cloro (Cl) e pelo oxigénio (O). A sua fórmula química é ClO 2. É um gás amarelo-esverdeado. Não ocorre naturalmente no meio ambiente. No processo de reação entre o sal de clorito de sódio e o ácido clorídrico, forma-se dióxido de cloro, sal comum e água.
5 NaClO2 + 4 HCl → 4ClO2 + 5 NaCl + 2 H2O
Existem outras formas de produção, mas não são relevantes neste contexto.
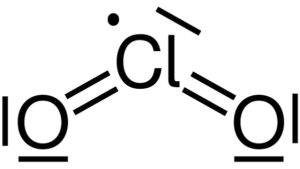
Estrutura de Lewis do dióxido de cloro ClO2. Yikrazuul [Public domain]. Fonte: Wikimedia Commons.
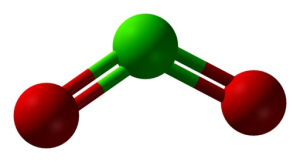
Estrutura do ClO2 em três dimensões. Verde=cloro; vermelho=oxigénio. Ben Mills and Jynto [Public domain]. Fonte: Wikimedia Commons.
É importante distinguir entre as propriedades do dióxido de cloro como gás e como solução aquosa
Propriedades como Gás
Link: https://gestis-database.dguv.de/data?name=001640
- Estado físico: Gás amarelo-esverdeado a amarelo-avermelhado.
- Peso molecular: 67,45 g/mol.
- Ponto de fusão: -59 ºC.
- Ponto de ebulição: 11 ºC.
- ORP (potencial redox) : 0.94V
Densidade: 1,642 g/cm3. @ Temp: 0 °C, Gás = 2,33 (densidad relativa ao ar, ar=1) - Pressão de vapor: 140 kPa a 20 °C[2]
Temperatura crítica: 192 °C
O ClO2 tem um peso molecular de 67,45 g/mol e um estado de oxidação padrão de +4 para os átomos de Cl. - O ClO2 tem um ponto de ebulição de 11 ºC, um ponto de fusão de -59 ºC, uma densidade de 1,64 g/mL (líquido) a 0 ºC, uma solubilidade em água de 3,0 g/L a 25 ºC e um valor kPa de 3,0. É muito solúvel em água e não se hidrolisa.
- Tem um odor semelhante ao do cloro e é tóxico se inalado em grandes quantidades durante um período de tempo prolongado.
- É solúvel em água, muito solúvel e não se hidrolisa.
- Os vapores concentrados de ClO2 são potencialmente explosivos, especialmente quando se encontram no ar em concentrações superiores a 10%. Não devem ser comprimidos, quer seja de fomra isolada ou em mistura com outros gases, devido ao risco de explosão por compressão ou por efeito da luz solar UV.
- O ClO2 como gás decompõe-se instantaneamente em contacto com materiais orgânicos. Pode também reagir na presença de mercúrio (Hg) ou monóxido de carbono (CO).
- Sob a ação da luz ultravioleta (UV) ou do ozono, o ClO2 é convertido em hexóxido de cloro (Cl206), um composto muito instável.
Propriedades das suas soluções aquosas
Link: https://gestis-database.dguv.de/data?name=531775
Está classificado como aditivo alimentar E-926.
- Solubilidade em água: Concentração: 3 g/l – Pressão parcial: 4,6 kPa – Temperatura: 25 °C
- Estado físico: Gás de cor amarela dissolvido em água (CDS)
- As soluções aquosas de dióxido de cloro são amarelo-esverdeadas na água e o seu grau indica a sua concentração.
- Em solução aquosa, o dióxido de cloro é altamente solúvel e não se hidrolisa para formar outras moléculas com o hidrogénio da água.
- Mantêm-se estáveis se estiverem bem fechadas em frascos de vidro castanho.
- O CDS difunde-se através dos plásticos devido ao seu pequeno tamanho de aproximadamente 140 picómetros.
- Recomenda-se que o concentrado de CDS seja mantido frio, bem fechado e protegido da luz solar.
- Na presença de luz, decompõe-se lentamente formando ácido clorídrico (HCl) e ácido clórico (HClO3), baixando o pH da solução.
- Em soluções alcalinas, o ClO2 descompõe-se em iões clorito (ClO2-) e em soluções muito alcalinas, acima de pH 10, em clorato (ClO3-).
- Em soluções ácidas, forma-se ácido cloroso (HClO2), que se decompõe em ácido clorídrico (HCl) e ácido clórico (HClO3).
- O espetro de absorção ultravioleta das soluções de ClO2 tem uma banda larga com um pico a 360 nm e um coeficiente de extinção molar de ~1250 M-1 cm-1.
- É importante distinguir entre a mistura de clorito de sódio com um ácido e o gás dissolvido por si só, uma vez que têm comportamentos diferentes. A mistura cria uma reação oscilante contínua, enquanto o gás dissolvido em água é estável e é conhecido como CDS. A mistura tem um potencial redox +5, enquanto o gás dissolvido em água tem +4 e não reage com o HCl.
- É usado para purificar a água e torná-la segura para beber devido à sua eficácia contra vírus, bactérias e fungos.
Aplicações médicas
As soluções aquosas de ClO2 têm sido utilizadas para tratar a candidíase oral (infeção na boca). A candidíase é uma infeção causada pelo fungo Candida albicans. O dióxido de cloro elimina os fungos da boca e melhora significativamente o aspeto dos tecidos orais sem efeitos secundários.
As soluções de ClO2 aplicadas a feridas cirúrgicas podem diminuir ou suprimir a formação de aderências sem afetar a cicatrização da ferida, com a vantagem adicional das suas propriedades antisséticas.
Foi utilizado e aprovado para a desinfeção de sacos de doação de sangue contra a contaminação viral em 1993 (Alcide).
Foi utilizado com êxito contra o coronavírus SARS-CoV-2 na sequência da lei aprovada na Bolívia, bem como noutros países.
Graças à comprovação da sua eficácia clínica, há muita investigação médica em curso sobre esta substância para muitas aplicações.
A absorção a partir de uma solução aquosa de ClO2 ocorre rapidamente num período de 7-15 minutos. O agente químico absorvido é provavelmente o gás, de acordo com a segunda lei de difusão de gás da lei de Fick.