La química del CDS
Composición y Aplicaciones
El dióxido de cloro es un compuesto inorgánico formado por el elemento cloro (Cl) y el oxígeno (O). Su fórmula química es ClO2. Es un gas color de amarillo verdoso. No se encuentra de forma natural en el ambiente. En el proceso de reacción entre la sal del clorito sódico y el ácido clorhídrico, se produce la formación de dióxido de cloro, sal común y agua.
5 NaClO2 + 4 HCl → 4ClO2 + 5 NaCl + 2 H2O
Hay otras formas de Producción pero no son relevantes en este espacio.
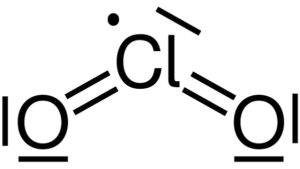
Estructura Lewis del dióxido de cloro ClO2. Yikrazuul [Public domain]. Fuente: Wikimedia Commons.
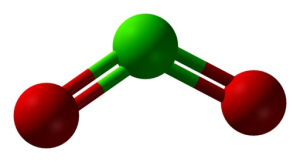
Estructura del ClO2 en tres dimensiones. Verde=cloro; rojo=oxígeno. Ben Mills and Jynto [Public domain]. Fuente: Wikimedia Commons.
Es importante diferenciar entre las propiedades del dióxido de cloro como gas o como solución acuosa
Propiedades como Gas
Link: https://gestis-database.dguv.de/data?name=001640
- Estado físico: Gas de color amarillo verdoso a amarillo rojizo.
- Peso molecular: 67,45 g/mol.
- Punto de fusión: -59 ºC.
- Punto de ebullición: 11 ºC.
- ORP (potencial redox) : 0.94V
Densidad: 1,642 g/cm3. @ Temp: 0 °C, Gas = 2,33 (densidad relativa al aire, aire=1) - Presión de vapor: 140 kPa a 20 °C[2]
Temperatura crítica: 192 °C
El ClO2 tiene un peso molecular de 67,46 y un estado de oxidación estándar de +4 para los átomos de Cl. - El ClO2 tiene un punto de ebullición de 11 ºC, un punto de fusión de -59 ºC, una densidad de 1,64 g/mL (líquido) a 0 ºC, una solubilidad en agua de 3,0 g/L a 25 ºC y un valor pKa de 3,0. Es muy soluble en agua y no se hidroliza.
- Tiene un olor similar al cloro y es tóxico si se inhala en grandes cantidades de forma prolongada.
- Es soluble en agua, muy soluble y no hidroliza.
- Los vapores concentrados de ClO2 son potencialmente explosivos, especialmente cuando se encuentran en el aire a una concentración mayor al 10%. No se deben comprimir, ya sea solos o mezclados con otros gases, debido al riesgo de explosión por compresión o por el efecto de la luz UV solar.
- El ClO2 como gas se descompone instantáneamente al contacto con materiales orgánicos. También puede reaccionar en presencia de mercurio (Hg) o monóxido de carbono (CO).
- Bajo la acción de la luz ultravioleta (UV) o del ozono, el ClO2 se convierte en hexóxido de cloro (Cl206), un compuesto muy inestable.
Propiedades de sus soluciones acuosas
Link: https://gestis-database.dguv.de/data?name=531775
Es clasificado como Aditivo alimentario E-926
- Solubilidad en agua: Concentración: 3 g/l – Presión parcial 4,6 kPa – Temperatura: 25 °C
- Estado físico: Gas de color amarillo disuelto en agua (CDS)
- Las soluciones acuosas de dióxido de cloro son amarillo verdoso en agua y su grado indica su concentración.
- En solución acuosa, el dióxido de cloro es altamente soluble y no se hidroliza formando otras moléculas con el hidrógeno del agua.
- Son estables si están bien selladas en botella de cristal marrón
- El CDS difunde a través de plásticos debido a su pequeño tamaño de aproximadamente 140 picómetros.
- Se recomienda conservar el concentrado de CDS en frío, bien sellado y protegidas de la luz solar.
- En presencia de luz, se descompone lentamente formando ácido clorhídrico (HCl) y ácido clórico (HClO3) bajando el pH de la solución.
- En soluciones alcalinas, el ClO2 se descompone en iones clorito (ClO2-) y en soluciones muy alcalinas , por encima de pH 10 en clorato (ClO3-).
- En soluciones ácidas, se forma ácido cloroso (HClO2) y luego se descompone en ácido clorhídrico (HCl) y ácido clórico (HClO3).
- El espectro de absorción ultravioleta de las soluciones de ClO2 tiene una amplia banda con un pico a 360 nm y un coeficiente de extinción molar de ~1250 M-1 cm-1.
- Es importante diferenciar entre la mezcla de clorito sódico con un ácido y el gas disuelto por sí solo, ya que tienen comportamientos diferentes. La mezcla crea una reacción oscilante continua, mientras que el gas disuelto en agua es estable y se conoce como CDS. La mezcla tiene un potencial redox+5, mientras que el gas disuelto en agua tiene +4 y no reacciona con HCl.
- Se utiliza para purificar agua y hacerla segura para beber debido a su eficacia contra virus, bacterias y hongos.
Aplicaciones médicas
Las soluciones acuosas de ClO2 se han empleado para tratar candidiasis orales (infección en la boca). La candidiasis es una infección por el hongo Cándida albicans. El dióxido de cloro elimina el hongo de la boca y mejora significativamente la apariencia de los tejidos bucales sin efectos secundarios.
Las soluciones de ClO2 aplicadas a heridas de operaciones quirúrgicas pueden disminuir o suprimir la formación de adhesiones sin afectar la curación de la misma, con la ventaja adicional de sus propiedades antisépticas.
Se ha utilizado y fue aprobado para la desinfección de Bolsas de donaciones de sangre contra la contaminación Viral 1993 (Alcide).
Se ha utilizado con éxito contra el Sars-cov-2 del coronavirus tras la ley aprobada al respecto en Bolivia y en mas países.
Debido a evidencias de su eficacia clínica hay muchas investigaciones medicas nuevas al respecto para muchas aplicaciones en curso.
La absorción a partir de una solución acuosa de ClO2 se produce rápidamente entre 7-15 min. El agente químico absorbido es probablemente el Gas según la segunda ley de difusión de gases de la ley de Fick.