La chimie du CDS
Composition et applications
Le dioxyde de chlore est un composé inorganique constitué de l’élément chlore (Cl) et de l’oxygène (O). Sa formule chimique est ClO 2. C’est un gaz jaune verdâtre. Il n’est pas présent naturellement dans l’environnement. La réaction entre le chlorite de sodium et l’acide chlorhydrique produit du dioxyde de chlore, du sel ordinaire et de l’eau.
5 NaClO2 + 4 HCl → 4ClO2 + 5 NaCl + 2 H2O
Il existe d’autres formes de production, mais elles ne sont pas pertinentes dans le cadre de cet espace.
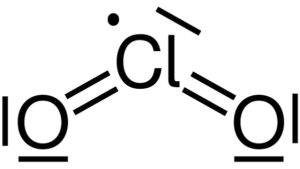
Structure de Lewis du dioxyde de chlore Dioxyde de chlore ClO2. Yikrazul [Public domain]. Source : Wikimedia Commons.
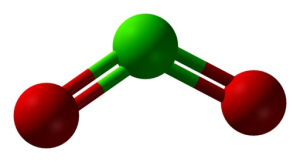
Structure du ClO2 en trois dimensions. Vert=chlore ; rouge=oxygène. Ben Mills and Jynto [Public domain]. Source : Wikimedia Commons.
Il est important de différencier les propriétés du dioxyde de chlore sous forme de gaz ou de solution aqueuse.
Propriétés en tant que gaz
Lien: https://gestis-database.dguv.de/data?name=001640
- État physique : gaz jaune verdâtre à jaune rougeâtre.
- Poids moléculaire : 67,45 g/mol.
- Point de fusion : -59 ºC.
- Point d’ébullition : 11 ºC.
- ORP (potentiel d’oxydoréduction) : 0,94V
Densité : 1,642 g/cm3. Temp : 0 °C, Gaz = 2,33 (densité par rapport à l’air, air=1) - Pression de vapeur : 140 kPa à 20 °C[2].
Température critique : 192 °C
Le ClO2 a un poids moléculaire de 67,46 et un état d’oxydation standard de +4 pour les atomes de Cl. - Le ClO2 a un point d’ébullition de 11 ºC, un point de fusion de -59 ºC, une densité de 1,64 g/mL (liquide) à 0 ºC, une solubilité dans l’eau de 3,0 g/L à 25 ºC et une valeur pKa de 3,0. Il est très soluble dans l’eau et ne s’hydrolyse pas.
- Il a une odeur similaire à celle du chlore et est toxique s’il est inhalé en grandes quantités pendant une période prolongée.
- Il est soluble dans l’eau, très soluble et ne s’hydrolyse pas.
- Les vapeurs concentrées deClO2 sont potentiellement explosifs, en particulier lorsqu’ils se trouvent dans l’air à des concentrations supérieures à 10 %. Il ne doit pas être comprimé, seul ou en mélange avec d’autres gaz, en raison du risque d’explosion par compression ou par l’effet de la lumière solaire UV.
- Le ClO2 sous forme de gaz, se décompose instantanément au contact des matières organiques. Il peut également réagir en présence de mercure (Hg) ou de monoxyde de carbone (CO).
- Sous l’action de la lumière ultraviolette (UV) ou de l’ozone, le ClO2 est transformé en hexoxyde de chlore (Cl206), un composé très instable.
Propriétés de leurs solutions à causes
Lien: https://gestis-database.dguv.de/data?name=531775
Il est classé comme additif alimentaire E-926.
- Solubilité dans l’eau : Concentration : 3 g/l – Pression partielle 4,6 kPa – Température : 25 °C
- État physique : gaz jaune dissous dans l’eau (CDS)
- Les solutions aqueuses de dioxyde de chlore sont jaune verdâtre dans l’eau et leur degré indique leur concentration.
- En solution aqueuse, le dioxyde de chlore est très soluble et ne s’hydrolyse pas pour former d’autres molécules avec l’hydrogène de l’eau.
- Ils sont stables s’ils sont bien scellés dans des bouteilles en verre brun.
- Le CDS se diffuse à travers les plastiques en raison de sa petite taille d’environ 140 picomètres.
- Il est recommandé de conserver le concentré CDS au froid, bien fermé et à l’abri de la lumière du soleil.
- En présence de lumière, se décompose lentement pour former de l’acide chlorhydrique (HCl) et de l’acide chlorique.(HClO3) en diminuant le pH de la solution.
- Dans les solutions alcalines, le ClO2 se décompose en ions chlorite(ClO2-) et dans les solutions très alcalines, au-dessus de pH 10 dans le chlorate (ClO3-).
- Dans les solutions acides, l’acide chloreux se forme (HClO2) et se décompose ensuite en acide chlorhydrique (HCl) et en acide chlorique (HClO3).
- Les spectres d’absorption dans l’ultraviolet des solutions de ClO2 présente une large bande avec un pic à 360 nm et un coefficient d’extinction molaire de ~1250 M-1 cm-1.
- Il est important de faire la différence entre le mélange de chlorite de sodium avec un acide et le gaz dissous seul, car ils ont des comportements différents. Le mélange crée une réaction oscillante continue, tandis que le gaz dissous dans l’eau est stable et est connu sous le nom de CDS. Le mélange a un potentiel d’oxydoréduction de +5, tandis que le gaz dissous dans l’eau a un potentiel de +4 et ne réagit pas avec le HCl.
- Il est utilisé pour purifier l’eau et la rendre potable grâce à son efficacité contre les virus, les bactéries et les champignons.
Applications médicales
Les solutions aqueuses de ClO2 ont été utilisés pour traiter la candidose buccale (infection de la bouche). La candidose est une infection par le champignon Candida albicans. Le dioxyde de chlore élimine les champignons de la bouche et améliore considérablement l’apparence des tissus buccaux sans effets secondaires.
Les solutions de ClO2 appliqués aux plaies chirurgicales peuvent réduire ou supprimer la formation d’adhérences sans affecter la cicatrisation des plaies, avec l’avantage supplémentaire de leurs propriétés antiseptiques.
Il a été utilisé et approuvé pour la désinfection des poches de dons de sang contre la contamination virale en 1993 (Alcide).
Il a été utilisé avec succès contre le coronavirus Sars-cov-2 à la suite de la loi adoptée en Bolivie et dans d’autres pays.
En raison des preuves de son efficacité clinique, il fait l’objet de nombreuses nouvelles recherches médicales pour de nombreuses applications en cours.
L’absorption à partir d’une solution aqueuse de ClO2 se produit rapidement en 7 à 15 minutes. L’agent chimique absorbé est probablement le gaz selon la deuxième loi de diffusion des gaz de la loi de Fick.