Chimica dei CDS
Composizione e applicazioni
Il diossido di cloro è un composto inorganico costituito dall’elemento cloro (Cl) e dall’ossigeno (O). La sua formula chimica è ClO 2. È un gas giallo-verdastro. Non si trova naturalmente nell’ambiente. Nel processo di reazione tra il sale di clorito di sodio e l’acido cloridrico si formano biossido di cloro, sale comune e acqua.
5 NaClO2 + 4 HCl → 4ClO2 + 5 NaCl + 2 H2O
Esistono altre forme di produzione, ma non sono rilevanti in questo spazio.
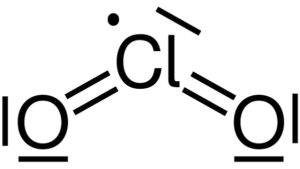
Struttura di Lewis del biossido di cloro Biossido di cloro ClO2. Yikrazuul [Public domain]. Fonte: Wikimedia Commons.
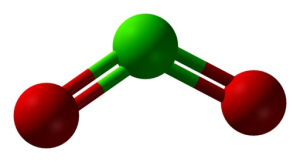
Struttura del ClO2 in tre dimensioni. Verde=cloro; rosso=ossigeno. Ben Mills e Jynto [Public domain]. Fonte: Wikimedia Commons.
È importante distinguere tra le proprietà del biossido di cloro come gas o come soluzione acquosa.
Proprietà come gas
Link: https://gestis-database.dguv.de/data?name=001640
- Stato fisico: gas di colore da giallo-verdastro a giallo-rossastro.
- Peso molecolare: 67,45 g/mol.
- Punto di fusione: -59 ºC.
- Punto di ebollizione: 11 ºC.
- ORP (potencial redox) : 0.94V
Densità: 1,642 g/cm3. @ Temp: 0 °C, Gas = 2,33 (densità relativa all’aria, aria=1) - Pressione di vapore: 140 kPa a 20 °C[2].
Temperatura crítica: 192 °C
Il ClO2 ha un peso molecolare di 67,46 e uno stato di ossidazione standard di +4 per gli atomi di Cl. - Il ClO2 ha un punto di ebollizione di 11 ºC, un punto di fusione di -59 ºC, una densità di 1,64 g/mL (liquido) a 0 ºC, una solubilità in acqua di 3,0 g/L a 25 ºC e un valore pKa di 3,0. È molto solubile in acqua e non si idrolizza.
- Ha un odore simile al cloro ed è tossico se inalato in grandi quantità per un periodo di tempo prolungato.
- È idrosolubile, molto solubile e non si idrolizza.
- Vapori concentrati di ClO2 sono potenzialmente esplosivi, soprattutto se presenti nell’aria in concentrazioni superiori al 10%. Non devono essere compressi, né da soli né in miscela con altri gas, a causa del rischio di esplosione per compressione o per effetto della luce solare UV.
- Il ClO2 come gas si decompone istantaneamente a contatto con materiali organici. Può reagire anche in presenza di mercurio (Hg) o monossido di carbonio (CO).
- Sotto l’azione della luce ultravioletta (UV) o dell’ozono, la ClO2 viene convertito in esossido di cloro (Cl206), un composto molto instabile.
Proprietà delle loro soluzioni aroba
Link: https://gestis-database.dguv.de/data?name=531775
È classificato come additivo alimentare E-926.
- Solubilità in acqua: Concentrazione: 3 g/l – Pressione parziale 4,6 kPa – Temperatura: 25 °C
- Stato fisico: gas giallo disciolto in acqua (CDS)
- Le soluzioni acquose di biossido di cloro sono giallo-verdastre in acqua e il loro grado indica la loro concentrazione.
- In soluzione acquosa, il biossido di cloro è altamente solubile e non si idrolizza per formare altre molecole con l’idrogeno dell’acqua.
- Sono stabili se ben sigillati in bottiglie di vetro marrone.
- Il CDS si diffonde attraverso la plastica grazie alle sue dimensioni ridotte di circa 140 picometri.
- Si raccomanda di conservare il concentrato CDS al freddo, ben sigillato e al riparo dalla luce solare.
- In presenza di luce, si decompone lentamente per formare acido cloridrico (HCl) e acido clorico. (HClO3) abbassando il pH della soluzione.
- Nelle soluzioni alcaline, il ClO2 si decompone in ioni clorito (ClO2-) e in soluzioni molto alcaline, al di sopra di pH 10 nel clorato (ClO3-).
- In soluzioni acide, l’acido clorotico forma (HClO2) e si decompone in acido cloridrico (HCl) e acido clorico (HClO3).
- Gli spettri di assorbimento ultravioletto delle soluzioni di ClO2 ha una banda larga con un picco a 360 nm e un coefficiente di estinzione molare di ~1250 M-1 cm-1 .
- È importante distinguere tra la miscela di clorito di sodio con un acido e il gas disciolto da solo, poiché hanno comportamenti diversi. La miscela crea una reazione oscillante continua, mentre il gas disciolto in acqua è stabile ed è noto come CDS. La miscela ha un potenziale redox +5, mentre il gas disciolto in acqua ha +4 e non reagisce con l’HCl.
- Viene utilizzato per purificare l’acqua e renderla sicura da bere grazie alla sua efficacia contro virus, batteri e funghi.
Applicazioni mediche
Soluzioni acquose di ClO2 sono stati utilizzati per trattare la candidosi orale (infezione della bocca). La candidosi è un’infezione causata dal fungo Candida albicans. Il biossido di cloro elimina i funghi dalla bocca e migliora significativamente l’aspetto dei tessuti orali senza effetti collaterali.
Il ClO2 applicati alle ferite chirurgiche possono ridurre o sopprimere la formazione di aderenze senza influenzare la guarigione della ferita, con l’ulteriore vantaggio delle loro proprietà antisettiche.
È stato utilizzato e approvato per la disinfezione delle sacche per le donazioni di sangue contro la contaminazione virale nel 1993 (Alcide).
È stato utilizzato con successo contro il coronavirus Sars-cov-2 in seguito alla legge approvata in Bolivia e in altri Paesi.
Grazie all’evidenza della sua efficacia clinica, sono in corso numerose nuove ricerche mediche su di esso per molte applicazioni.
L’assorbimento da una soluzione acquosa di ClO2 avviene rapidamente entro 7-15 minuti. L’agente chimico assorbito è probabilmente il gas secondo la seconda legge di diffusione dei gas della legge di Fick.