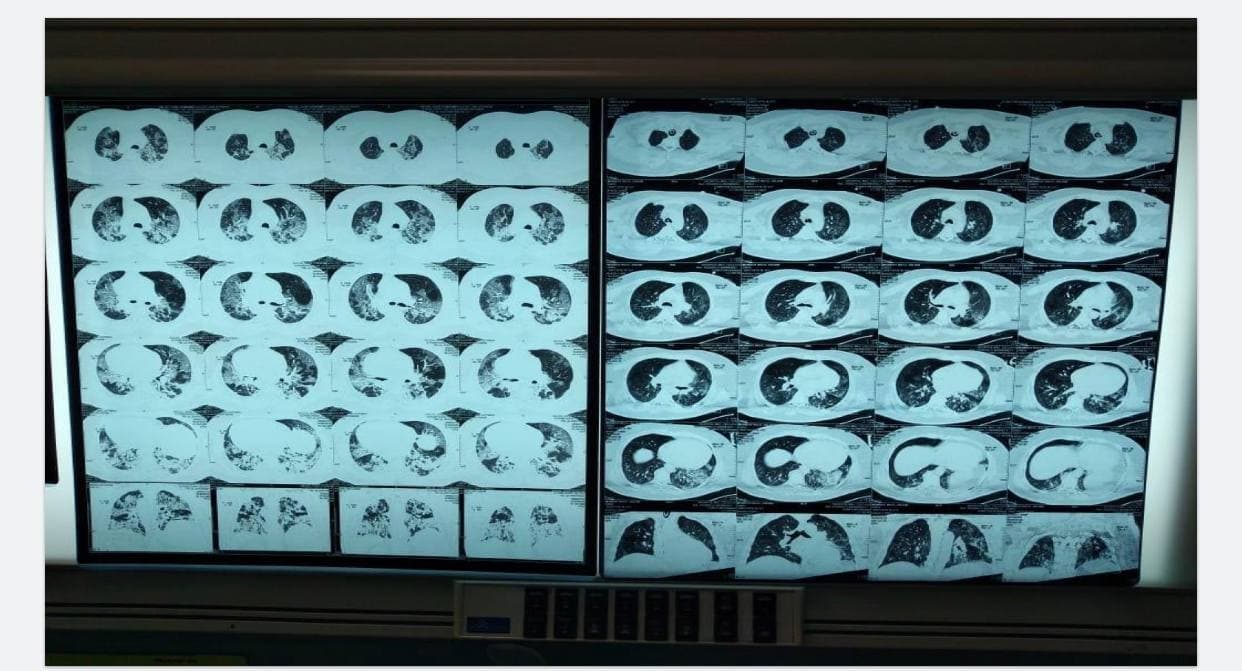
Données cliniques
Macro étude de :
Dr. Manuel Aparicio-Alonso, Carlos A. Domínguez-Sánchez* et Marina Banuet-Martínez
Département des Sciences Naturelles, Centre Médical Jurica, Queretaro, Mexique.:
Résumé
En décembre 2019, le premier cas de COVID-19 a été signalé à Wuhan, en Chine, et s’est rapidement propagé dans le monde entier. La maladie a causé des millions de morts et, à ce jour, il n’existe pas de médicament totalement efficace contre cette maladie. Cette étude a évalué les effets négatifs et positifs du dioxyde de chlore. (ClO2) comme thérapie alternative pour le traitement du COVID-19. Des informations ont été recueillies à partir des dossiers médicaux de 1136 patients traités pour le COVID-19 avec trois protocoles différents d’une solution aqueuse de ClO2 à une dose moyenne de 1,41 mg/kg.
Le délai moyen de disparition des symptômes était de 4,84 jours et le traitement complet a duré 15,87 jours. En outre, 6,78 % des patients ont présenté des effets indésirables légers et sporadiques tels que des maux de tête, des vertiges, des vomissements, des diarrhées et des nausées. Il n’y a pas eu d’effets secondaires mettant en danger la santé des patients. Les analyses sanguines n’ont révélé aucune anomalie systémique après la consommation de ClO2. Les enzymes hépatiques, le glucose, le cholestérol total et les triglycérides sont revenus à la normale à la fin du traitement. 99,03 % des patients sont sortis de l’hôpital sans complications. Nos résultats montrent que, lorsqu’il est utilisé à la bonne concentration et au bon dosage, le ClO2 en tant que solution permet de traiter efficacement le COVID-19 tout en étant sans danger pour la consommation humaine.
Introduction
La nouvelle maladie signalée fin 2019 (COVID-19), causée par le nouveau coronavirus SARS-CoV-2, se caractérise principalement par des symptômes respiratoires aigus accompagnés de fièvre, de malaises, de maux de tête et, parfois, de symptômes digestifs et nerveux. [1,2] Ces symptômes sont causés par des réponses inflammatoires excessives [3,4] et des coagulopathies dûes à des lésions endothéliales causées par la protéine Spike du SARS-CoV-2 [5].
Depuis le début des années 2020, date à laquelle l’Organisation Mondiale de la Santé l’a déclarée, la pandémie de COVID-19 a gravement affecté la plupart des pays en termes de morbidité et de mortalité, ainsi qu’en termes de coût économique et social des mesures prises pour endiguer la pandémie. L’un des principaux défis posés par cette maladie a été de trouver des médicaments efficaces pour traiter le COVID-19 [6].
Le dioxyde de chlore (ClO2) est un gaz soluble utilisé dans différents pays pour désinfecter l’eau potable. [7-9] en raison de son activité antimicrobienne[10]. En présence d’air et d’eau, le ClO2 se répartit entre les deux phases selon un rapport d’équilibre déterminé par la température et la pression atmosphérique [11].
On sait que le ClO2 dénature les résidus de tyrosine et de tryptophane par oxydation [10,12], et a également une action modulatrice sur le système immunitaire, puisqu’il inhibe la transcription de la protéine NF-kB [13,14]. Dans ce contexte, on peut supposer que le ClO2 peut réagir avec la protéine SAR-CoV-2 Spike (composée de 54 résidus de tyrosine, 12 de tryptophane et 40 de cystéine) et inactiver le virus.[15]
En outre, en neutralisant les molécules d’oxygène réactives et les cytokines avec le ClO2 [16,17], il est possible de contrôler l’inflammation excessive associée aux cas graves de COVID-19 [1].
Bien que des résidus de cystéine, de tyrosine et de tryptophane puissent également être trouvés dans les tissus humains, le ClO2 est beaucoup moins toxique pour les humains ou les animaux que pour les bactéries et les virus en raison de sa sélectivité en fonction de la taille. [16,18] et en raison de la teneur en antioxydants tels que le glutathion dans les cellules de mammifères[19].
Alors que le ClO2 a été classé comme composé dangereux lorsqu’il est utilisé pour d’autres applications sous d’autres formes et à d’autres doses, en raison de certains effets secondaires non létaux signalés.[19], il est important de considérer que ces cas sont principalement des rapports cliniques d’intoxication avec d’autres substances telles que le chlorite de sodium (NaClO2) ou de l’hypochlorite de sodium (Eau de Javel, NaClO), et non du ClO2 sous forme de CDS. Indépendamment, les autorités sanitaires ont publié des informations trompeuses qui manquent de preuves scientifiques sur la toxicité de ce composé chimique, ce qui affecte le développement et la mise en œuvre du ClO2 en tant que traitement possible du COVID-19.
À ce jour, aucun des médicaments approuvés ou autorisés en urgence par la Food and Drug Administration (FDA) pour traiter le COVID-19 n’a démontré une grande efficacité en termes de réduction des symptômes, d’hospitalisation ou de décès.
Il est donc fondamental d’évaluer de nouveaux composés susceptibles de réduire l’impact de la pandémie actuelle, tels que l’ivermectine. [20,21]
Les preuves de la sécurité et de l’efficacité du ClO2 commence tout juste à être acceptée par la communauté médicale, bien qu’elle ne soit pas encore acceptée par les institutions règlementaires officielles.
Ici, nous avons examiné les données médicales de 1136 patients atteints de COVID-19 qui ont utilisé du ClO2 (CDS) comme traitement alternatif. Nous avons évalué les effets secondaires de la consommation de CDS et son efficacité potentielle dans la prévention des maladies graves et des décès.
Matériels et méthodes
Collecte des données : information de base et cliniques. Les dossiers cliniques de 1136 patients COVID-19 positifs/suspects (traités par le même médecin) qui ont volontairement demandé une prise en charge thérapeutique à domicile au Mexique ont été examinés; ces dossiers couvraient la période du 30 mai 2020 au 15 janvier 2021.
Les critères d’inclusion dans les registres cliniques étaient les suivants :
Les patients diagnostiqués par des tests moléculaires (transcriptase inverse en temps réel (RT-PCR) pour le SARS-CoV-2, détection d’antigènes, immunoglobuline M (IgM) et immunoglobuline G (IgG) spécifiques contre le SARS-CoV-2), tomographie pulmonaire assistée par ordinateur, radiographie thoracique ou une combinaison de manifestations cliniques telles que maux de tête, fièvre, toux, maux de gorge, dyspnée, malaise et fatigue. [1,22];
les patients qui ont été informés des avantages et des effets secondaires possibles de la prise de ClO2 avant le début du traitement et qui ont signé le formulaire de consentement éclairé.
Les variables recueillies dans les dossiers médicaux étaient les suivantes : sexe, âge, comorbidités, médications antérieures, date d’apparition, date de sortie ou date de décès, effets secondaires consécutifs à la consommation de CDS, millilitres de ClO2 consommés par jour (“ClO2 par jour”), saturation partielle en oxygène (SpO2), supplément d’oxygène (O2 L/min) et des symptômes similaires à ceux de COVID-19.
En outre, six variables ont été calculées pour chaque patient à partir des données collectées : durée des symptômes semblables à ceux du COVID-19 (« jours de symptômes »), durée du traitement (« durée du traitement »), millilitres de ClO2 consommé pendant le traitement (« ClO2 total”), doses de ClO2 pendant le traitement (“doses de ClO2”), coût du ClO2 par jour (« coût par jour ») et le coût total du ClO2 pour l’ensemble du traitement (« coût total »).En outre, la gravité de la maladie des patients (légère, modérée ou grave) a été déterminée en fonction des paramètres définis dans les lignes directrices relatives au traitement des maladies à coronavirus (COVID-19) [23] et les algorithmes provisoires pour les soins du COVID-19 de l’Institut Mexicain de la Sécurité Sociale[24].
Prise en charge thérapeutique : Solution de dioxyde de chlore Deux groupes de patients ont été analysés :
Patients polymédicamentés : personnes prenant des médicaments normalement utilisés pour traiter COVID-19 (azithromycine, dexaméthasone, ivermectine et hydroxychloroquine) plus une solution de dioxyde de chlore, et
les patients exclusivement avec le ClO2 : personnes traitées uniquement avec une solution de dioxyde de chlore. Tous les patients ont été traités à domicile par leurs proches ou des infirmières suivant les instructions du médecin traitant.
Deux types de solutions aqueuses orales de ClO2 à 3000 ppm (3 mg/ml) ont été utilisés pour traiter le COVID-19 : Protocole C (ClO2 dans 1000 ml d’eau, répartis en dix prises de 100 ml, administrées par voie orale toutes les heures, par jour) et Protocole F (ClO2 dans 500 ml d’eau, répartis en dix prises de 50 ml à administrer par voie orale toutes les 15 minutes, 1 à 5 fois par jour).
Pour l’utilisation par voie intraveineuse, Protocole Y (ClO2 dans 500 ml de sérum physiologique stérile à 0,9 % plus 5 ml de gluconate de calcium à 10 % et 10 ml de bicarbonate de sodium à 7,5 %, administrés à raison de 70 ml par heure en moyenne).
Tous les patients ont commencé le traitement par le protocole F et, en fonction de la gravité de la maladie, ont été placés sous les protocoles C, F ou Y jusqu’à ce que les symptômes disparaissent.
Après la disparition des symptômes, ils ont poursuivi le protocole C comme traitement d’entretien jusqu’à la fin du traitement (14 à 21 jours selon la gravité de la maladie).
Le ClO2 utilisé par les patients pour un usage oral a été fabriqué en oxydant du chlorite de sodium à 28 % (NaClO2) et 4% d’acide chlorhydrique (HCl) comme activateur [19]. Pour une utilisation intraveineuse, le ClO2 a été produit par la méthode de l’électrolyse à membrane [9].
Selon les instructions données à chaque patient, le ClO2 a été conservé dans une bouteille fermée, à l’abri de la lumière directe du soleil et à une température inférieure à 11°C.[19,25].
État physique général des patients : Les symptômes déclarés volontairement par les patients ont été utilisés pour calculer l’incidence de chaque symptôme, comme dans le cas du COVID-19.
Les patients décédés au cours de la maladie ont été considérés comme des cas de traitement infructueux.
L’état clinique des patients a été évalué dans un sous-ensemble de 57 patients (principalement des cas graves de COVID-19) pour lesquels des données sur une numération sanguine complète et un test de biomarqueurs métaboliques étaient disponibles avant et après le traitement.
Comme valeurs de référence, nous utilisons celles rapportées pour la population mexicaine adulte en bonne santé. [26,27]
Analyse statistique
Une première analyse des données à l’aide de statistiques descriptives a permis d’obtenir une vue d’ensemble des informations de base des patients inclus dans cette étude. Avant d’analyser correctement les données, la distribution de chaque variable a été examinée.
Les variables s’écartaient d’une distribution normale et il y avait des signes d’hétéroscédasticité; nous avons donc utilisé des tests de Kruskal-Wallis pour comparer les valeurs du ClO2 par jour, jours de symptômes, durée du traitement, la quantité totale administrée de ClO2, la dose de ClO2, coût par jour et coût total en fonction de la gravité de la maladie (légère, modérée et grave).
La durée des symptômes et la durée du traitement parmi les comorbidités ont également été analysées à l’aide de tests de Kruskal-Wallis.
Le test de rang signé de Wilcoxon a été utilisé pour comparer le nombre de jours de symptômes et la durée du traitement entre les patients ayant reçu plusieurs médicaments et ceux ayant reçu uniquement du ClO2.2, ainsi que de comparer les résultats des analyses sanguines (numération globulaire complète et panel de biomarqueurs métaboliques) avant et après le traitement.
L’efficacité du traitement a été évaluée en divisant les cas d’échec par le nombre total de patients.
Un modèle de régression linéaire log-transformé a été mis en place pour analyser l’association entre la durée du traitement jusqu’à la fin des symptômes et la SpO2 et O2 L/min. Une régression logistique a été effectuée pour analyser l’association de l’âge, du sexe et des comorbidités avec la gravité de la maladie.
Une valeur a été considérée comme p <0,05 comme statistiquement significatif. Les résultats continus ont été mesurés sous forme de différence moyenne et d’intervalles de confiance (IC) à 95 %. Afin de réduire le biais de déclaration dans cette étude, le médecin traitant n’a pas été impliqué dans la numérisation et l’analyse statistique.
Toutes les analyses ont été effectuées à l’aide de Rv.3.6.1. [28]. Approbation éthique Le Comité d’Ethique du Centre Médical Jurica a renoncé à l’approbation éthique et à l’obtentiron du consentement pour la collecte, l’analyse et la publication des données recueillies rétrospectivement, car il s’agit d’une étude non interventionnelle dans laquelle les informations ont été saisies à partir d’anciens dossiers médicaux, en préservant l’anonymat de chaque individu et parce que tous les patients ont signé un formulaire de consentement éclairé avant le traitement.
Disponibilité des données Les ensembles de données utilisés et analysés dans le cadre de cette étude sont disponibles sur demande raisonnable auprès de l’auteur correspondant.
Résultats
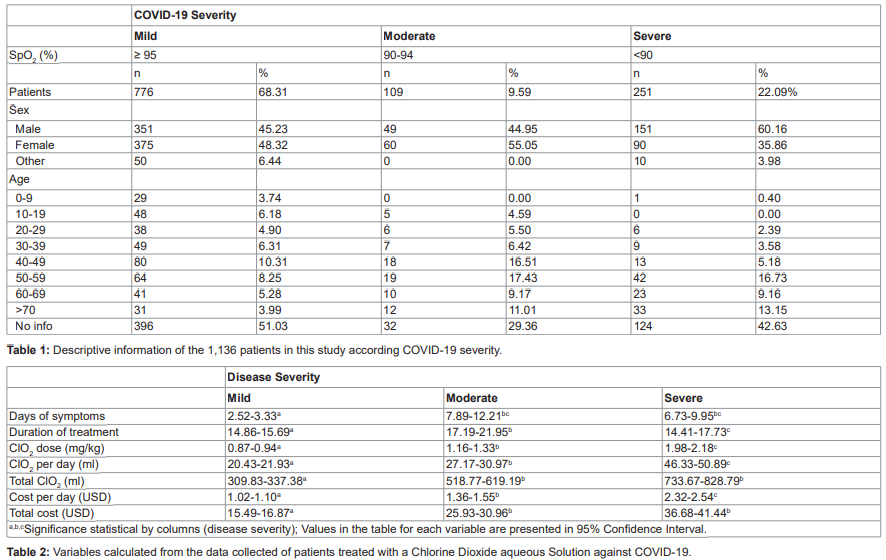
Analyse descriptive des patients Les données primaires ont été recueillies auprès de 1 136 patients (tableau 1) dans 30 États du Mexique, principalement à Querétaro (53,07 %), Mexico (10,22 %) et Jalisco (5,11 %).
Sur l’ensemble de l’échantillon, 487 (42,87 %) patients ont été diagnostiqués positifs au COVID-19 par test moléculaire ou imagerie diagnostique ; les 649 patients restants (57,13 %) ont été diagnostiqués en raison de symptômes semblables à ceux du COVID-19. À la fin du traitement, 213 (18,75 %) patients ont subi un test de détection des anticorps spécifiques du SRAS-CoV-2, et 154 (72,30 %) étaient positifs (93 pour les IgG et 61 pour les IgM).
Les patients ont été classés selon la gravité de la maladie en trois groupes : léger, modéré et sévère, en fonction des symptômes et de la SpO2.
L’étude a porté sur 551 (48,50 %) hommes, 525 (46,21 %) femmes et 60 (5,28 %) personnes dont le sexe n’était pas renseigné. La gravité était associée au sexe (x2=16,89, df=2, P=0,0002) ; les hommes étaient 1,8 fois plus susceptibles que les femmes de développer un cas grave de COVID-19 (RR=1,8, IC à 95 % : 1,33-2,42), P<0.001). L’âge moyen était de 46,72 ans (de 1 à 93 ans), et le COVID-19 était plus répandu dans les groupes d’âge 40-49 ans et 50-60 ans (19,01 %, 21,04 %, respectivement). Le risque de développer une maladie grave a été déterminé par l’âge (x2=82, dF=7, dF=7)., P<0.0001), augmentant de 4 % par année de vie (OR=1,04, IC 95 % : 1,03-1,05), P<0.001).
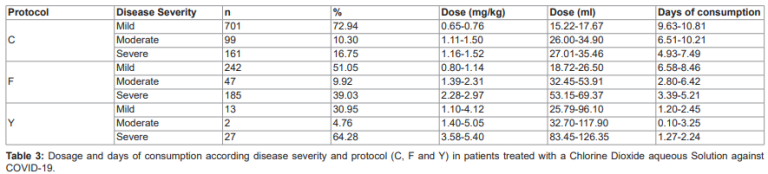
Le risque de développer une maladie plus grave était le plus élevé après l’âge de 30 ans (figures S1 et S2). Au total, 25 symptômes différents ont été signalés par les patients, les symptômes les plus fréquents (tableau S1) étant les suivants : maux de tête (49,65 %), malaise (44,45 %), mal de gorge (37,41 %), fièvre (22,89 %), toux sèche (17,34 %), faiblesse (14,70 %), douleur thoracique (12,32 %), dyspnée (9,5 %), anosmie (9,15 %) et agueusie (8,71 %). La durée moyenne des symptômes était de 4,84 jours (IC 95 % : 4,32-5,36 jours) et différait selon la gravité de la maladie (légère : 2,52 à 3,33 jours, modérée : 7,89 à 12,21 jours et sévère : 6,73 à 9,95 jours ; Kruskal-Wallis, x2=234,89, df=2, P<0.001) (Table 2).
Société Internationale de Médecine Orthomoléculaire
ISSN:0834-4825
Auteur(es): Michael J Gonzalez1,3‚4; Jorge R Miranda-Massari2‚4; Peter A McCullough5; Paul E Marik6; Pierre Kory7; Ryan Cole8; Geert Vanden Bossche9; Charles Simone10; Manuel Aparicio Alonso11; Ernesto Prieto Gratacos12; Atsuo Yanagisawa13; Richard Cheng14; Eduardo Insignares-Carrione15; Zhiyong Peng¹6; Robert J Rowen¹7; Teresa B Su¹7; Frank Shallenberger18; David Brownstein19; Thomas Levy20; Jorge L Cubrias21; Arturo O’Byrne Navia22; Arturo O’Byrne De Valdenebro23; Alex Vasquez24; Ron Hunninghake25; Andrew Saul26; Hugo Galindo27; Andreas L. Kalcker28; Mayca Gonzalez29; Luis A Bonilla-Soto30; María Carrascal31; José W Rodriguez Zayas32; Efrain Olszewer33; Michaël Friedman34; Miguel J Berdiel35; Norman O Gonzalez36; Jose Olalde37; Ines Alfaro38; Roberto Ortiz39; Angie Perez40; Carlos H. Orozco Araya41; Luis Martinez42; Rosalina Valcarcel43; Sylvia Nuñez Fidalgo44; Fernando Pinto Floril45; Raul Morales Borges46; José R Rodriguez-Gomez47; José A Rodriguez-Robles48; Ramphis Diaz49; Carlos M Ricart50
- Université de Porto Rico, Campus des sciences médicales, École de santé publique, San Juan PR.
- Université de Porto Rico, Campus des sciences médicales, École de pharmacie, San Juan PR.
- Université Centrale de Caribe, Ecolé de Chiropractie, Bayamón, PR.
- EDP University, Programme de Science Naturopatique, Hato Rey, PR.
- Fondation Truth for Health, Tucson, AZ.
- Front Line COVID-19 Alliance pour les soins intensifs(FLCCC) et École de médecine de Virginie orientale, Département de médecine interne, VA.
- Front Line COVID-19 Alliance pour les soins intensifs, Madison, WI.
- Cole Diagnostics, Garden City, ID.
- Virologue indépendant et expert en vaccins, Colonia, Bélgica.
- Centre de cancérologie Simone Protective, Lawrenceville, NJ.
- Centre médical Jurica, Querétaro, México.
- Oncologie métabolique de précision 12, Cambridge Science Park, Cambridge, Angleterre.
- Collège japonais de thérapie intraveineuse, Tokyo, Japon ; Société japonaise de médecine orthomoléculaire, Tokyo, Japon : Société internationale de médecine orthomoléculaire, Toronto, Canada.
- Centre de santé intégrative Cheng, Centre de perte de poids du docteur, Colombie, SC.
- Association du Liechtenstein pour la science et la santé, Liechtenstein, Suisse.
- Hôpital Zhognnan, Université de Wuhan, Wuhan, Hubei, Chine.
- Cabinet médical privé, Santa Rosa, Californie.
- Cabinet médical privé, Carson City, NV.
- Le Centre de médecine holistique à West Bloomfield, MI.
- Clinique Riordan, Wichita, KS.
- Clinique Cellmedik, Santa Cruz de Tenerife, Espagne.
- Cabinet privé, Bogotá, Colombie.
- Cabinet privé d’immunologie clinique, Buenos Aires, Argentine.
- Collège international de nutrition humaine et de médecine fonctionnelle, Barcelone, Espagne.
- Clinique Riordan, Wichita, KS.
- Doctor Yourself.com, Rochester, NY.
- Centre Médical Country, Bogotá, Colombie.
- Recherche indépendante en biophysique, Berne, Suisse.
- Clinique Centro, Granade, España.
- Université de Porto Rico, Campus des sciences médicales, École de santé publique, Département de santé environnementale, San Juan, PR.
- Clinique Carrascal, Río Piedras, PR.
- Centre de recherche cardio-pulmonaire, Guaynabo, PR ;
- Fundacao de apoio e pesquisa na área de saude-foundation pour la recherche en santé et en médecine Sao Paulo, Brésil.
- Association pour l’avancement de la médecine restauratrice (AARM), Montpelier, VT.
- Clinique Berdiel, Ponce PR.
- Pratique privée de la naturopathie, programme de maîtrise en naturopathie, université EDP de Porto Rico. San Juan, PR.
- Centre médical régénératif (CMR), Bayamón et Caguas PR.
- Institut Alpha, Caguas, PR.
- Université holistique, département de nutrition, Mexico City, Mexique.
- Centre médical ICEMI, San José, Costa Rica, CA.
- Cabinet médical privé, San José, Costa Rica, CA.
- Clinique Xanogene, San Juan, PR.
- Cabinet médical privé, San Juan, PR.
- Hôpital de la ville de San Juan, service des urgences, San Juan, PR.
- Cabinet médical privé, Quito, Équateur.
- Santé optimale intégrative de Porto Rico, MB & R’s Enterprise, Institut d’hématologie Ashford & Oncologie, San Juan, PR.
- Université Carlos Albizu, San Juan, PR.
- Cabinet médical privé, San Juan, PR, y Miami, FL.
- Cabinet privé de naturopathie, San Juan, PR.
- Université de Porto Rico, Campus de Cayey, Département de biologie, Cayey, PR.
Résumé
La pandémie de SRAS-CoV-2 a créé une situation mondiale sans précédent. En plus d’une nouvelle maladie infectieuse et d’une réponse mondiale sans précédent, un plan d’action sans précédent en matière de recherche, de production, d’essai et de distribution de vaccins a également été mis en place. Le sentiment d’urgence qui entoure la lutte contre la pandémie virale a conduit à des décisions de santé publique fondées sur des informations incomplètes et non vérifiées.
De nombreuses questions relatives au SRAS-Cov-2, au COVID-19 et au système immunitaire doivent être abordées, clarifiées et mises en perspective afin que cette pandémie puisse être évaluée de manière plus objective. Cette analyse peut aider à gérer plus efficacement les nombreux défis auxquels ils sont confrontés, et offrir une réelle opportunité de réduire les complications, les décès et les effets secondaires iatrogènes de l’infection ou de la vaccination, ou des deux.
Ce rapport de consensus a entrepris cette tâche nécessaire afin de fournir une base commune pour gérer efficacement cette situation mondiale.
Médecine moléculaire et génétique ISSN: 1747-0862
Eduardo Insignares-Carrione*, Blanca Bolano Gómez y Andreas Ludwig Kalcker
Introduction
Le COVID-19 est une maladie infectieuse causée par le virus SARS-CoV-2. Il a été détecté pour la première fois dans la ville chinoise de Wuhan (province de Hubei) en décembre 2019. En l’espace de trois mois, elle s’est répandue dans pratiquement tous les pays du monde, ce qui a conduit l’Organisation mondiale de la santé à la déclarer pandémique. (OMS, 11 mars 2020).
Il n’existe pas de traitement spécifique ; les principales mesures thérapeutiques consistent à soulager les symptômes et à maintenir les fonctions vitales. La recherche d’un traitement efficace a commencé dès que l’on a pris conscience de l’ampleur pandémique de la maladie. Le problème central est que, onze mois après son apparition officielle, il n’existe toujours pas de traitement efficace connu pour cette maladie. En l’absence de traitement efficace, nous explorons de nouvelles possibilités thérapeutiques dans le but de trouver un traitement efficace et sûr pour le COVID-19.
En conséquence, cette recherche aborde les résultats actuels et les recherches précédentes en ajoutant l’action thérapeutique possible du dioxyde de chlore en solution aqueuse et sans la présence de chlorite de sodium comme agent virucide en utilisant les concepts de la médecine translationnelle basés sur la connaissance de la structure du virus et le mécanisme d’action du dioxyde de chlore sur les virus, afin de proposer un traitement possible de choix pour COVID-19. [1,2].
Journal intégratif des sciences médicales (ISSN : 2658-8218)
Enrique A. Martínez Université catholique du Nord, Coquimbo, Chili
https://doi.org/10.15342/ijms.7.229
https://mbmj.org/index.php/ijms/article/view/229
RESUME:
Cet article a pour but d’encourager les équipes médicales du monde entier à contacter les patients du COVID-19 déjà traités avec une solution de dioxyde de chlore (CDS), un gaz soluble dans l’eau. Ils doivent également contacter les équipes médicales qui accompagnent les cas étudiés afin de vérifier l’état de santé réel des patients. Enfin, nous vous invitons à vous demander si le CDS devrait être testé dans vos établissements de santé locaux, car il est peu coûteux, semble très efficace contre toutes les infections virales et n’a pratiquement pas d’effets secondaires.
Le dioxyde de chlore comme traitement alternatif pour le COVID-19
Journal des maladies infectieuses et de la thérapie.
Manuel Aparicio-Alonso, C. Domínguez-Sánchez, Marina Banuet-Martinez
RESUME:
À ce jour, il n’existe pas d’agent prophylactique efficace pour prévenir le COVID-19. Cependant, le développement de symptômes similaires à ceux du COVID19 a pu être évité grâce à une solution aqueuse de dioxyde de chlore. (ClO2). Cette étude rétrospective a évalué l’efficacité d’une solution aqueuse de ClO2 (CDS) en tant qu’agent prophylactique chez 1 163 membres de la famille vivant avec des patients COVID positifs/suspects19.
Le traitement prophylactique consistait en une solution de dioxyde de chlore (CDS) à 0,0003 % par voie orale pendant au moins 14 jours. Les cas réussis ont été considérés comme les membres de la famille dont les antécédents médicaux ne faisaient état d’aucun développement de symptômes de type COVID19. L’efficacité de la CDS dans la prévention des symptômes de type covid19 était de 90,4 % (1 051 membres de la famille sur 1 163 n’ont signalé aucun symptôme).
Les comorbidités, le sexe et la gravité de la maladie du patient malade n’ont pas contribué à l’apparition de symptômes de type covid19 (P = 0,092, P = 0,351 et P = 0,574, respectivement). Cependant, les parents plus âgés étaient plus susceptibles de développer des symptômes de type covid19 (ORa = 4,22, P = 0,002). Aucune modification des paramètres sanguins ou de l’intervalle QTc n’a été observée chez les parents ayant consommé du CDS. Les récentes découvertes sur le dioxyde de chlore justifient la conception d’essais cliniques visant à évaluer son efficacité dans la prévention de l’infection par le SRAS-CoV-2.
Interaction moléculaire et inhibition de la liaison du SARS-CoV-2 au récepteur ACE2
Nature communications chemistry selections (ISSN :2188-5044)
Jinsung Yang, Simon J. L. Petitjean, Melanie Koehler, Qingrong Zhang, Andra C. Dumitru, Wenzhang Chen, Sylvie Derclaye, Stéphane P. Vincent, Patrice Soumillion & David Alsteens
Résumé
L’étude des interactions entre les glycoprotéines virales et leurs récepteurs hôtes est d’une importance vitale pour une meilleure compréhension de l’entrée des virus dans les cellules. L’entrée du nouveau coronavirus SARS-CoV-2 dans les cellules hôtes est médiée par sa glycoprotéine d’entrée (S-glycoprotéine), et l’enzyme de conversion de l’angiotensine 2 (ACE2) a été identifiée comme un récepteur cellulaire. Nous utilisons ici la microscopie à force atomique pour étudier les mécanismes par lesquels la S-glycoprotéine se lie au récepteur ACE2.
Nous démontrons, à la fois sur des surfaces modèles et dans des cellules vivantes, que le domaine de liaison au récepteur (RBD) sert d’interface de liaison au sein de la S-glycoprotéine avec le récepteur ACE2 et nous extrayons les propriétés cinétiques et thermodynamiques de cette poche de liaison. L’ensemble de ces résultats donne une image de l’interaction établie dans les cellules vivantes. Enfin, nous avons testé plusieurs peptides inhibiteurs de liaison ciblant les premières étapes de l’attachement au virus, ce qui ouvre de nouvelles perspectives dans le traitement de l’infection par le SARS-CoV-2.
Revue internationale de recherche et d’analyse multidisciplinaire
1Manuel Aparicio-Alonso,2 Carlos A. Domínguez-Sánchez, 3Marina Banuet-Martínez
(ISSN :2643-9875) https://doi.org/10.47191/ijmra/v4-i8-14
RESUME:
La maladie à coronavirus 2019 (COVID19) a suscité de vives inquiétudes sur le plan sanitaire et surchargé les institutions de santé. Au fur et à mesure que le nombre de patients atteints de COVID19 se rétablit, la fréquence des signalements de symptômes de type COVID19 après la sortie de l’hôpital augmente également. Une enquête téléphonique avec des questions standardisées a demandé aux participants s’ils avaient subi l’une des 25 séquelles possibles après avoir été diagnostiqués avec le COVID19 et traités avec une solution de dioxyde de chlore (CDS).
Cent soixante et une personnes ont répondu à l’enquête. L’augmentation de l’âge s’est avérée être un facteur de risque (OR = 1,035, p = 0,028, 95% CI = 1,004-1,069), et la probabilité d’avoir des symptômes chez les patients modérés est de 0,077 par rapport aux patients légers (p = 0,003). Selon les prévisions, 64,6 % des patients traités par CDS pour une infection par le SRAS-CoV-2 ont subi une moyenne de 3,41 effets à long terme. Le nombre de séquelles rapportées ne varie pas en fonction du sexe, de l’âge, de la gravité de la COVID19 ou de la méthode de traitement.
Les cinq symptômes les plus fréquents parmi les 25 différents symptômes à long terme observés dans cette étude sont la fatigue, la perte de cheveux, la dyspnée, les problèmes de concentration et les troubles du sommeil. En outre, les personnes traitées avec plusieurs médicaments (traitement conventionnel COVID19 plus le CDS) ont eu 2,7 cas de séquelles en moins, et les patients traités exclusivement avec un CDS ont eu 6,14 cas d’effets à long terme en moins. Les personnes recevant du CDS sont 19 % moins susceptibles d’avoir des effets à long terme sur leur santé que les patients recevant un traitement COVID19 standard. Selon les résultats de cette étude, les patients qui reçoivent du CDS sont moins susceptibles de développer des séquelles.
En outre, l’incidence des effets à long terme est plus faible chez les personnes traitées exclusivement par le CDS. Les récentes découvertes relatives au dioxyde de chlore soutiennent le développement d’études cliniques visant à évaluer son efficacité dans la prévention du développement des effets à long terme du COVID19.
REVUE INTERNATIONALE DE RECHERCHE ET D’ANALYSE MULTIDISCIPLINAIRE
1Manuel Aparicio-Alonso, 2Carlos A. Domínguez-Sánchez, 3Marina Banuet-Martínez
RESUME:
À ce jour, il n’existe pas d’agent prophylactique efficace pour prévenir le COVID-19. Cependant, le développement de symptômes similaires à ceux du COVID19 a pu être évité grâce à une solution aqueuse de dioxyde de chlore. (ClO2). Cette étude rétrospective a évalué l’efficacité d’une solution aqueuse de ClO2 (CDS) en tant qu’agent prophylactique chez 1 163 membres de la famille vivant avec des patients COVID positifs/suspects19.
Le traitement prophylactique consistait en une solution de dioxyde de chlore (CDS) à 0,0003 % par voie orale pendant au moins 14 jours. Les cas réussis ont été considérés comme les membres de la famille dont les antécédents médicaux ne faisaient état d’aucun développement de symptômes de type COVID19. L’efficacité du CDS dans la prévention des symptômes de type covid19 était de 90,4 % (1 051 membres de la famille sur 1 163 n’ont signalé aucun symptôme). Les comorbidités, le sexe et la gravité de la maladie du patient malade n’ont pas contribué à l’apparition de symptômes de type covid19 (P = 0,092, P = 0,351 et P = 0,574, respectivement).
Cependant, les parents plus âgés étaient plus susceptibles de développer des symptômes de type covid19 (ORa = 4,22, P = 0,002). Aucune modification des paramètres sanguins ou de l’intervalle QTc n’a été observée chez les parents ayant consommé du CDS. Les récentes découvertes sur le dioxyde de chlore justifient la conception d’essais cliniques visant à évaluer son efficacité dans la prévention de l’infection par le SRAS-CoV-2.
Etude comparative du dioxyde de chlore hyperpur avec deux autres irrigants en relation avec la viabilité des cellules souches du ligament parodontal.
Orsolya Láng, Krisztina S. Nagy, Julia Láng, Katalin Perczel-Kovách, Anna Herczegh, Zsolt Lohinai, Gábor Varga & László Kőhidai
Springer (ISSN: 2627-8626)
Résumé
Objectifs : Les cellules souches du ligament parodontal (PDLSC) sont d’une importance capitale car leur capacité proliférative élevée et leur différenciation multipotente offrent un potentiel thérapeutique important. L’intégrité de ces cellules est fréquemment perturbée par les composés d’irrigation couramment utilisés comme désinfectants parodontaux ou endodontiques (par exemple, le peroxyde d’hydrogène, l’eau oxygénée, etc.). [H2O2] et la chlorhexidine[CHX]). Nos objectifs étaient (i) de contrôler l’effet cytotoxique d’un nouveau composé d’irrigation dentaire, le dioxyde de chlore. (ClO2), par rapport à deux acteurs traditionnels(H2O2, CHX) sur les PDLSC et (ii) de vérifier si le facteur de vieillissement des cultures de PDLSC détermine la réactivité cellulaire aux produits chimiques testés.
Évaluations cliniques contrôlées du dioxyde de chlore, du chlorite et du chlorate chez l’homme
Perspectives en matière de santé environnementale (EHP)
J R Lubbers, S Chauan, y J R Bianchine
Résumé
Une étude contrôlée a été menée pour évaluer la sécurité relative des désinfectants de l’eau au chlore administrés de manière chronique chez l’homme. L’évaluation clinique s’est déroulée selon les trois phases communes aux études de médicaments expérimentaux. La phase I, une étude de tolérance à doses croissantes, a examiné les effets aigus de doses uniques progressivement croissantes de désinfectants au chlore sur des volontaires adultes masculins en bonne santé.
Dans la phase II, l’impact sur des sujets normaux de l’ingestion quotidienne de désinfectants à une concentration de 5 mg/l a été étudié. pendant douze semaines consécutives. Les personnes ayant un faible taux de glucose-6-phosphate déshydrogénase devraient être particulièrement sensibles au stress oxydatif ; c’est pourquoi, dans la phase III, le chlorite a été administré à une concentration de 5 mg/l. quotidiennement pendant douze semaines consécutives à un petit groupe de sujets présentant un déficit en glucose-6-phosphate déshydrogénase potentiellement à risque.
L’impact physiologique a été évalué à l’aide d’une batterie de tests qualitatifs et quantitatifs. Les trois phases de cette évaluation clinique contrôlée en double aveugle du dioxyde de chlore et de ses éventuels métabolites chez des volontaires masculins se sont déroulées sans incident. Aucune séquelle clinique indésirable évidente n’a été observée par l’un des sujets participants ou par l’équipe médicale chargée de l’observation. Dans plusieurs cas, des tendances statistiquement significatives de certains paramètres biochimiques ou physiologiques associés au traitement ont été observées ; cependant, aucune de ces tendances n’a été considérée comme ayant des conséquences physiologiques. Il n’est pas exclu que, sur une période de traitement plus longue, ces tendances puissent effectivement atteindre des proportions cliniquement significatives. Cependant, en l’absence de réactions physiologiques néfastes dans les limites de l’étude, la sécurité relative de l’ingestion orale de dioxyde de chlore et de ses métabolites, le chlorite et le chlorate, a été démontrée.
Biochimie ACS PUB
Norio Ogata
Résumé

Composés oxychlorés, tels que l’acide hypochloreux (HOCl) et le dioxyde de chlore (ClO2), ont une puissante activité antimicrobienne. Si le mécanisme biochimique de l’activité antimicrobienne du HOCl a été largement étudié, on sait peu de choses sur celui du ClO2. En utilisant l’albumine sérique bovine et la glucose-6-phosphate déshydrogénase de Saccharomyces cerevisiae comme protéines modèles, je démontre ici que l’activité antimicrobienne du ClO2 est principalement attribuable à son activité de dénaturation des protéines. Par analyse de solubilité, spectroscopie de dichroïsme circulaire, calorimétrie différentielle à balayage et mesure de l’activité enzymatique, je démontre que la protéine est rapidement dénaturée par le ClO2 avec une diminution concomitante de la concentration de ClO2 dans le mélange réactionnel. Les spectres de dichroïsme circulaire du ClO2 montrent un changement d’ellipticité à 220 nm, indiquant une diminution du contenu α-hélique. La calorimétrie différentielle à balayage montre que la température de transition et l’enthalpie de transition endothermique du clivage induit par la chaleur diminuent dans la protéine traitée avec le ClO2. L’activité enzymatique de la glucose-6-phosphate déshydrogénase diminue jusqu’à 10 % dans les 15 s de traitement avec 10 μM ClO.2. Les analyses élémentaires montrent que dans la protéine traitée avec le ClO2 les atomes d’oxygène sont incorporés, mais pas les atomes de chlore, ce qui prouve directement que la protéine est oxydée par le ClO2. En outre, la spectrométrie de masse et la spectroscopie de résonance magnétique nucléaire montrent que les résidus de tryptophane sont convertis en N-formylquinurénine et les résidus de tyrosine en 3,4-dihydroxyphénylalanine (DOPA) ou en 2,4,5-trihydroxyphénylalanine (TOPA) dans les protéines traitées au ClO2. Compte tenu de l’ensemble de ces résultats, j’en conclus que les microbes sont inactivés par le ClO2 due à la dénaturation des protéines constitutives essentielles à leur intégrité et/ou à leur fonction, et que cette dénaturation est principalement due à la modification oxydative covalente de leurs résidus de tryptophane et de tyrosine.
Les effets du dioxyde de chlore sur l’hygiène bucco-dentaire : revue systématique et méta-analyse
Autor(es): Beáta Kerémi, Katalin Márta, Kornélia Farkas, László M. Czumbel, Barbara Tóth, Zsolt Szakács, Dezső Csupor, József Czimmer, Zoltán Rumbus, Péter Révész, Adrienn Németh, Gábor Gerber, Péter Hegyi y Gábor Varga*
DOI: 10.2174/1381612826666200515134450
Résumé
Contexte : Des bains de bouche efficaces et sélectifs sont nécessaires dans la pratique médicale et dentaire quotidienne. Actuellement, les bains de bouche utilisés ont des effets secondaires importants.
Objectifs : Notre objectif était d’évaluer l’efficacité des bains de bouche contenant du dioxyde de chlore par rapport à d’autres bains de bouche précédemment établis chez des adultes en bonne santé en utilisant des indices d’hygiène bucco-dentaire.
Méthodes : Ce travail a été enregistré dans PROSPERO (CRD42018099059) et a été réalisé à l’aide de plusieurs bases de données et rapporté conformément à la déclaration PRISMA. Les termes de recherche utilisés étaient « dioxyde de chlore » ET « oral », et seuls les essais contrôlés randomisés (ECR) ont été retenus. Le résultat principal était la modification de l’indice de plaque (IP), tandis que les résultats secondaires étaient l’indice gingival (IG) et la numération bactérienne. L’outil Cochrane d’évaluation du risque de biais a été utilisé pour évaluer le risque de biais. (Cochrane Risk of Bias Tool). L’analyse statistique de l’hétérogénéité des données a été réalisée à l’aide de la valeur Q et des tests I2.
Résultats : 364 articles ont été trouvés dans les bases de données. À l’issue de la procédure de sélection, seuls cinq ECR étaient éligibles pour une méta-analyse. L’hétérogénéité des données était faible. Il n’y avait pas de différence statistique d’efficacité entre le dioxyde de chlore et les autres bains de bouche efficaces sur l’IP (0,720±0,119 vs. 0,745±0,131 ; intervalles de confiance (IC) à 95 % : 0,487-0,952 vs. 0,489-1,001, respectivement) et l’IG (0,712±0,130 vs. 0,745±0,131 ; IC à 95 % : 0,457-0,967 vs. 0,489- 1,001, respectivement) ainsi que sur les numérations bactériennes.
Conclusions : Le dioxyde de chlore réduit à la fois les indices de plaque et de gencive et les numérations bactériennes dans la cavité buccale de manière similaire à d’autres bains de bouche couramment utilisés, mais les preuves à l’appui de ce résultat sont très limitées. Il est donc nécessaire de réaliser davantage d’essais cliniques randomisés à grande échelle pour réduire le risque de biais.
Inorg. Chem. ACS PUB
Ana Ison, Ihab N. Odeh, y Dale W. Margerum
Résumé

L’oxydation de la cystéine (CSH) par le dioxyde de chlore dans des conditions de pseudo-premier ordre (avec un excès de CSH) dans des solutions aqueuses tamponnées est étudiée, p[H+] 2,7-9,5 a 25,0 °C. Les taux de désintégration du dioxyde de chlore sont du premier ordre à la fois pour le ClO2 et CSH et augmentent rapidement avec l’augmentation du pH. Le mécanisme proposé est un transfert d’électrons de CS- à ClO2 (1,03 × 108 M-1 s-1) avec une réaction rapide du radical CS- et en second le ClO2 pour former un adduit cystéinyl-ClO.2 (CSOClO). Cet adduit très réactif se décompose de deux manières.
Dans les solutions acides, hydrolysées pour donner CSO2H (acide sulfinique) et HOCl, qui réagissent rapidement pour former CSO3H (acide cystéique) et Cl-. En augmentant le pH, l’adduit (CSOClO) réagit avec CS- par une deuxième voie pour former de la cystine (CSSC) et des ions chlorite (ClO2-). La stœchiométrie de la réaction passe de 6 ClO2:5 CSH à faible pH à 2 ClO2:10 CSH à pH élevé. L’oxydation par le ClO2 de l’anion glutathion (GS-) est également rapide avec une constante de vitesse du second ordre de 1,40 × 108 M-1 s-1.
La réaction du ClO2 avec le CSSC est 7 fois plus lente que la réaction correspondante avec l’anion cystéinyle (CS-) à un pH de 6,7. L’ion chlorite réagit cependant avec le CSH à p[H+] 6.7, la vitesse observée de cette réaction est plus lente que celle de la réaction ClO2/CSH de 6 ordres de grandeur. L’ion chlorite oxyde le CSH lorsqu’il est réduit en HOCl, qui à son tour réagit rapidement avec le CSH pour former du Cl-. Les produits de la réaction sont le CSSC et le CSO3H avec une distribution dépendant du pH similaire à celle du ClO2/CSH.
M E Alvarez, R T O’Brien
Journal de virologie médicale
Résumé
Le dioxyde de chlore et l’iode inactivent le poliovirus plus efficacement à un pH de 10,0 qu’à un pH de 6,0. L’analyse par sédimentation de virus inactivés par le dioxyde de chlore et l’iode à un pH de 10,9 a montré que l’ARN viral était séparé des capsides, ce qui a entraîné la conversion des virions de structures 156S en particules 80S. Les ARN libérés par les virus inactivés par le dioxyde de chlore et les virus inactivés par l’iode ont été collés à l’ARN viral 35S intact. Le dioxyde de chlore et l’iode ont tous deux réagi avec les protéines de la capside du poliovirus et ont fait passer le pI de pH 7,0 à pH 5,8. Cependant, les mécanismes d’inactivation du poliovirus par le dioxyde de chlore et l’iode se sont révélés différents.
L’iode a inactivé les virus en diminuant leur capacité d’adsorption sur les cellules HeLa, tandis que les virus inactivés par le dioxyde de chlore ont montré une moindre incorporation de virus. [14C] uridine dans le nouvel ARN viral. Nous avons donc conclu que le dioxyde de chlore inactivait le poliovirus en réagissant avec l’ARN viral et en réduisant la capacité du génome viral à servir de matrice pour la synthèse de l’ARN.
Cinétique et mécanisme de la désinfection bactérienne par le dioxyde de chlore
Société américaine de microbiologie
Melvin A. Benarde, W. Brewster Snow, Vincent P. Olivieri, Burton Davidson
Résumé
Les données de survie sont présentées pour une souche fécale d’Escherichia coli exposée à trois concentrations de dioxyde de chlore à quatre températures. L’équation de réaction de premier ordre de Chick est généralisée à un modèle de pseudo-nième ordre. L’ajustement non linéaire des moindres carrés des données de survie au modèle d’ordre n’a été réalisé sur un ordinateur analogique. On a constaté que les données suivaient une cinétique d’ordre fractionnaire en ce qui concerne la concentration de survie, avec une énergie d’activation apparente de 12 000 cal/mol. Les premières expériences confirment la thèse selon laquelle le mécanisme de la mort par le dioxyde de chlore est une perturbation de la synthèse des protéines.
Étude sur la résistance des coronavirus associés au syndrome respiratoire aigu sévère
Elsevier
Xin-Wei Wang a, Jin-Song Li b, Min Jin a, Bei Zhen b, Qing-Xin Kong a, Nong Song a, Wen-Jun Xiao b, Jing Yin a, Wei Wei b, Gui-Jie Wang b, Bing-yin Si b, Bao-Zhong Guo b, Chao Liu c, Guo-Rong Ou a, Min-Nian Wang b, Tong-Yu Fang d, Fu-Huan Chao a, Jun-Wen Li
Résumé
Dans cette étude, la persistance du coronavirus associé au syndrome respiratoire aigu sévère (SARS-CoV) a été observée dans les fèces, l’urine et l’eau. En outre, l’inactivation du SARS-CoV dans les eaux usées à l’aide d’hypochlorite de sodium et de dioxyde de chlore a également été étudiée. Des expériences in vitro ont montré que le virus ne pouvait persister que pendant 2 jours dans les eaux usées hospitalières, les eaux usées domestiques et l’eau du robinet déchlorée, tandis qu’il persistait 3 jours dans les fèces, 14 jours dans le PBS et 17 jours dans l’urine à 20 °C. Toutefois, à 4 °C, le SARS-CoV peut persister pendant 14 jours dans les eaux usées et au moins 17 jours dans les fèces ou l’urine.
Le SARS-CoV est plus sensible aux désinfectants qu’Escherichia coli et le phage f2. On a constaté que le chlore libre inactive mieux le SARS-CoV que le dioxyde de chlore. Un résidu de chlore libre supérieur à 0,5 mg/L pour le chlore ou à 2,19 mg/L pour le dioxyde de chlore dans les eaux usées garantit l’inactivation complète du SARS-CoV, mais n’inactive pas complètement E. coli et le phage f2.
Effet protecteur du dioxyde de chlore à faible concentration
Journal de virologie générale
Norio Ogata1, Takashi Shibata1
RESUME
L’infection par le virus de la grippe est une cause majeure de morbidité et de mortalité chez l’homme. Chez l’homme, ce virus se propage principalement par les aérosols excrétés par le système respiratoire. Les moyens actuels de prévention de l’infection par le virus de la grippe ne sont pas entièrement satisfaisants en raison de leur efficacité limitée. Des mesures préventives sûres et efficaces contre la grippe pandémique sont nécessaires. Nous avons démontré que l’infection de la souris induite par le virus de la grippe A en aérosol était prévenue par le dioxyde de chlore gazeux (ClO2) à une concentration extrêmement faible (inférieure au niveau d’exposition à long terme autorisé pour l’homme, c’est-à-dire 0,1 p.p.m.).
Des souris placées dans des cages semi-fermées ont été exposées simultanément à des aérosols de virus de la grippe A (1 DL50) et de gaz ClO2 (0,03 p.p.m.) pendant 15 minutes. Trois jours après l’exposition, le titre pulmonaire du virus (TCID50) était de 102,6±1,5 chez cinq souris traitées au ClO2, alors qu’elle était de 106,7±0,2 chez cinq souris non traitées (P=0,003). La mortalité cumulée après 16 jours était de 0/10 souris traitées au ClO2 et 7/10 souris non traitées (P=0,002).
Lors d’expériences in vitro, le ClO2 dénature les protéines de l’enveloppe virale (hémagglutinine et neuraminidase) indispensables à l’infectivité du virus et supprime l’infectivité. Dans l’ensemble, nous concluons que le ClO2 est efficace pour prévenir l’infection par le virus de la grippe induite par les aérosols chez les souris en dénaturant les protéines de l’enveloppe virale à une concentration bien inférieure au niveau d’exposition admissible pour l’homme. Par conséquent, le gaz ClO2 pourrait être utile comme mesure préventive contre la grippe dans les lieux d’activité humaine ne nécessitant pas d’évacuation.
Tendances dans les biosciences
Jing Cao, Yirong Shi, Min Wen, Yuanyuan Peng, Qiqi Miao, Xiaoning Liu, Mingbin Zheng, Tetsuya Asakawa, Hongzhou Lu
https://doi.org/10.5582/bst.2022.01495
Résumé
Le dioxyde de chlore (ClO2) est un désinfectant de haut niveau sûr et largement utilisé pour la stérilisation. En raison des limitations dans la préparation d’une solution stable, l’utilisation directe de ClO2 dans le corps humain est limitée. L’irrigation nasale est une thérapie alternative utilisée pour traiter les maladies infectieuses respiratoires. Cette étude résume brièvement les données disponibles concernant la sécurité et l’efficacité de l’utilisation directe de ClO2 dans le corps humain, ainsi que l’approche de l’irrigation nasale pour traiter le COVID-19.
Sur la base des informations disponibles, ainsi que d’une expérience préliminaire qui a évalué de manière exhaustive l’efficacité et la sécurité du ClO2, Une concentration de 25 à 50 ppm a été considérée comme adéquate pour le ClO2 pour l’irrigation nasale afin de traiter le COVID-19. Cette constatation doit être vérifiée de manière plus approfondie. Cette constatation doit être vérifiée de manière plus approfondie. I’irrigation nasale avec le ClO2 peut être considéré comme une thérapie alternative possible pour traiter les maladies infectieuses respiratoires, et COVID-19 en particulier.
Littérature Éditeurs
Aparicio-Alonso M
Résumé
La régénération optimale des lésions cutanées doit assurer une protection contre les infections opportunistes qui peuvent entraver le processus de guérison ou augmenter le risque d’infection. L’utilisation d’antibiotiques pour prévenir l’infection peut, dans certains cas, interférer avec la régénération des tissus et échoue souvent en raison de souches bactériennes résistantes. Il est donc nécessaire d’élargir l’arsenal des options thérapeutiques sûres et efficaces disponibles. Nous documentons ici la prévention de l’infection et la réparation des tissus dans les lésions cutanées par des traitements basés sur une solution de dioxyde de chlore.
Nous avons documenté quatre rapports de cas, dont une brûlure abdominale due à un agent chimique, une brûlure palpébrale due à une chaleur extrême, une ulcération d’une extrémité due à une insuffisance vasculaire et un mélanome du cuir chevelu. Toutes les lésions ont été traitées par voie topique avec une solution de dioxyde de chlore, et par voie systémique si nécessaire, conformément aux protocoles précédemment proposés. Les quatre patients ont présenté une régénération dermique complète avec des résultats esthétiques, sans effets secondaires ni preuves d’effets indésirables ou d’interactions avec les traitements concomitants utilisés. Les résultats prouvent qu’une solution topique ou systémique de dioxyde de chlore est sûre en tant que traitement antiseptique dans la résolution adéquate et rapide des lésions cutanées.
Elservier
Laurent Schwartz a, Manuel Aparicio-Alonso b, Marc Henry c, Miroslav Radman d, Romain Attal e, Ashraf Bakkar f
https://doi.org/10.1016/j.freeradbiomed.2023.05.034
Résumé
Nous avons montré précédemment que la plupart des maladies présentent une forme d’anabolisme en raison d’une perturbation mitochondriale : dans le cas du cancer, une cellule fille est formée ; dans le cas de la maladie d’Alzheimer, les plaques amyloïdes; dans l’inflammation, les cytokines et les lymphokines.
L’infection par le Covid-19 suit un schéma similaire. Les effets à long terme comprennent une modification de l’oxydoréduction et un anabolisme cellulaire résultant de l’action de l’ effet Warburg et le dysfonctionnement mitochondrial. Cet anabolisme incessant conduit à la tempête de cytokines, fatigue chronique, la l’inflammation chronique ou les maladies neurodégénératives. Il a été démontré que des médicaments tels que l’ acide lipoïque et lebleu de méthylène améliorent l’activité mitochondriale, atténuent l’effet Warburg et augmentent le catabolisme. De même, la combinaison du bleu de méthylène, du dioxyde de chlore et l’acide lipoïque peuvent contribuer à réduire les effets à long terme de Covid-19 en stimulant le catabolisme.
Aperçu graphique

Elservier
N. Hatanaka , B. Xu , M. Yasugi , H. Morino , H. Tagishi , T. Miura , T. Shibata , S. Yamasaki
Résumé
Antécédents
Un nouveau coronavirus (SARS-CoV-2) est apparu brusquement à Wuhan, en Chine, en 2019 et s’est rapidement propagé dans le monde entier pour provoquer la pandémie de COVID-19.
Objectif
Examiner l’activité anti-SARS-CoV-2 du puissant désinfectant Cleverin, dont le principal composant désinfectant est le dioxyde de chlore. (ClO2); et comparer les résultats avec ceux de l’hypochlorite de sodium en présence ou en l’absence de 0,5 % ou 1,0 % de sérum bovin fœtal (FBS).
Méthodes
Des virus SARS-CoV-2 concentrés ont été traités avec différentes concentrations de ClO2 et l’hypochlorite de sodium, et la dose infectieuse de 50 % a été calculée dans une culture de tissus afin d’évaluer l’activité antivirale de chaque produit chimique.
Résultats
Lorsque les virus SARS-CoV-2 ont été traités avec 0,8 ppm de ClO2 ou de l’hypochlorite de sodium, le titre viral n’a diminué que de 1 log10 TCID50/mL en l’espace de 3 minutes. Cependant, le titre viral a diminué de plus de 4 log10 TCID50/mL lorsqu’il a été traité avec 80 ppm de chaque produit chimique pendant 10 s, indépendamment de la présence ou de l’absence de FBS. Il convient de noter que le traitement avec 24 ppm de ClO2 a inactivé plus de 99,99 % du SARS-CoV-2 en 10 s ou 99,99 % du SARS-CoV-2 en 1 min en présence de 0,5 % ou 1,0 % de FBS, respectivement. En revanche, l’hypochlorite de sodium à 24 ppm n’a inactivé que 99 % ou 90 % du SARS-CoV-2 en 3 minutes dans des conditions similaires.
En particulier, à l’exception du ClO2, les autres composants de Cleverin, tels que le chlorite de sodium, le monolaurate de décaglycérol et la silicone, n’ont pas montré d’activité antivirale significative.
Conclusion
Dans l’ensemble, les résultats suggèrent fortement que, bien que le ClO2 et l’hypochlorite de sodium sont de puissants agents antiviraux en l’absence de matière organique ; en présence de matière organique, le ClO2 est un agent antiviral plus puissant contre le SRAS-CoV-2 que l’hypochlorite de sodium.
Traitement au dioxyde de chlore Au total, 1 067 patients (93,96 %) sont sortis après 15,87 jours (IC 95 % : 15,35-16,39 jours) de traitement, 59 (5,19 %) ont abandonné après 11,43 jours (IC 95 % : 7,98-14,88 jours), et 10 (0,93 %) ont été hospitalisés après 8,6 jours (IC 95 % : 2,08-15,11 jours) de traitement, où ils sont décédés.
L’efficacité calculée du ClO2 était de 99,07 %. (1 057 patients sur 1 067 ont survécu).
Sur le nombre total de patients, 77 (6.78%) ont rapporté deseffets secondaires légers et sporadique après ingestion de ClO2: maux de tête (2,20 %), diarrhée (1,58 %), gastrite (1,32 %), vertiges (1,14 %), nausées (1,05 %), vomissements (0,44 %), éruption cutanée (0,44 %), maux de gorge (0,26 %), myalgie (0,18 %), colite (0,18 %), tachycardie (0,09 %) et frissons (0,09 %).
Ils ont été traités exclusivement avecdu CDS 666 patients (58,63%) et 470 patients (41,37%) ont été traités contre le VIH/SIDA.Le COVID-19 avec cinq médicaments ou plus en plus duCDS (Tableau S2).
La durée des symptômes chez les patients traités par CDS seul était inférieure à celle des patients traités par plusieurs médicaments (IC 95 % : 2,77-3,75 jours vs. 7,33-8,97 jours, respectivement ; Wilcoxon Rank Sum Test, P<0.001).
En fonction de la la gravité de la maladie et l’évolution des patients, différents protocoles ont été utilisés pendant le traitement. Neuf cent soixante et un (84.59%) patients ont utilisé le Protocole C, 474 (41.72%) ont utilisé le Protocole F et 42 (3.70%) ont utilisé le Protocole Y.
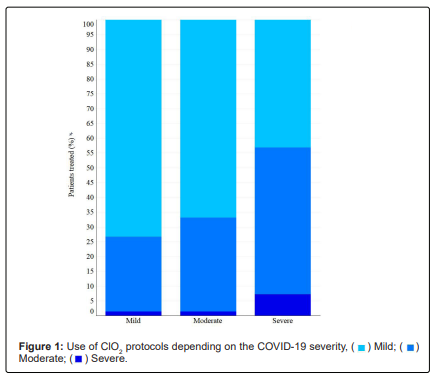
Le Protocole C a été largement utilisé chez les patients légers et modérés, le Protocole F chez les patients gravement malades et le Protocole Y était principalement utilisé comme traitement d’appoint dans les cas graves(Figure 1).
La dose journalière moyenne utilisée pour traiter les patients atteints de COVID-19 était de 1,41 mg/kg. (IC 95%: 0.97-1.85 mg/kg), correspondant à 32,95 ml par jour (IC 95%: 22.72-43.18 ml/jour) pendant 15,87 jours (IC 95%: 15.35-16.39jours).
Toutefois, pour chaque protocole (C, F y Y), la dose et les jours de consommation varient en fonction de la gravité de la maladie (Tableau 3).
En général, les patients ont été traités avec les doses et les durées suivantes : Protocole C (moyenne : 20,16 ml par jour [IC 95%: 18,94-21,37 ml/jour] pendant 8,99 jours [IC 95%: 8,46-9,52 jours]), Protocolo F (moyenne : 39,13 ml par jour[IC 95%: 35,34-42,92 ml/jour], 2,75 fois par jour [IC 95%: 2,53-2,97 apports/jour] pendant 5,36 jours [IC 95%: 4,74-5,98 jours]) ; et Protocole Y (moyenne : 89,92 ml par jour[IC 95%: 46,65-133,19 ml/jour] pendant 1,77 jours [IC 95%: 1,39-2,14 jours] en 2,12 perfusions par jour [IC 95%: 1,64-2,60 perfusions/jour]).
Neuf patients se sont gargarisés avec une solution aqueuse de 0.015% réalisé avec 5 ml de ClO2 dans 100 ml d’eau en cas de mal de gorge ou de congestion nasale.
Des différences ont été observées en ce qui concerne la durée du traitement (Kruskal-Wallis, x^2=30.42, df=2, P<0.001), la dose de ClO2 (Kruskal-Wallis, x^2=116.62, df=2, P<0.001) et le ClO2 por día (Kruskal-Wallis, x^2=72.20, df=2, P<0.001) chez les patients atteints d’une maladie légère, modérée ou grave du COVID-19(Tableau 3).
La moyenne du ClO2 consommés par les patients pendant toute la durée du traitement était de 557,94 ml (IC 95 % : 390,19-725,66), et était différente pour chaque gravité (légère : 309,83-337,38 ml, modérée : 518,77-619,19 ml et sévère : 733,67-828,79 ml ; Kruskal-Wallis, x^2=52,05, df=2, P<0.001). La durée moyenne estimée des symptômes est de 2.82 (IC 95%: 1.16, 4.47, p<0.001) jours de moins par mg/kg de ClO2, l’ajustement à la gravité.
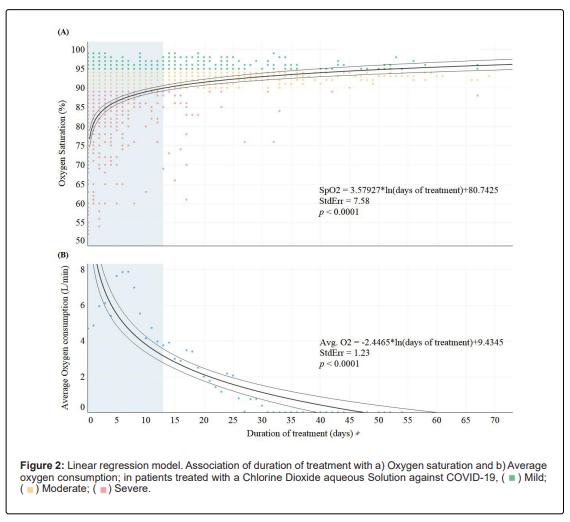
Bien-être physique général Les patients ont commencé le traitement avec une moyenne de SpO2 del 86.05% (IC 95%: 85.12-87.17%), l’augmentation de l’oxygène dans le sang chaque jour du traitement. Au total, 126 patients (101/251 [40 .24%] avec des symptômes graves, 21/109 [19 .27%] avec des symptômes modérés et 4/776 [0 .51%] avec des symptômes légers) ont utilisés l’oxygène supplémentaire (moyenne : 5,77 litres par minute [IC 95 % : 5,18-6,36 L/min] pendant 4,32 jours [IC 95 % : 3,37-5,27 jours]).
Entre le 7e et le 8e jour après le début du traitement, les 90% des patients ont signalé une augmentation de la SpO2 plus de 90 %. et une semaine plus tard au-dessus de 95 %, à un taux de SpO2=3.58ln(durée du traitement)(Figure 2a).
Les jours pour atteindre les 90% de SpO2 ne diffère pas entre les patients ayant reçu un supplément d’oxygène et ceux qui n’en ont pas reçu (IC 95 % : 7,53-9,47 jours, P=1,00) ; cependant, il a fallu près de cinq jours de moins pour que les patients ayant reçu un supplément d’oxygène aient un SpO2 de 95% par rapport à ceux qui ne l’ont pas utilisé (IC 95%: 12.53-14.47 jours vs. 18,52-20,48 jours, P=0.004).
La supplémentation en oxygène a diminué à un taux de -2,45ln (durée du traitement). (Figure 2b). En outre, la durée et la quantité d’oxygène administrée différaient selon la gravité (Kruskal-Wallis, x^2=9,6382, df=2, P=0,008 ; x^2=16,89, df=2, P=0,002 ; respectivement).
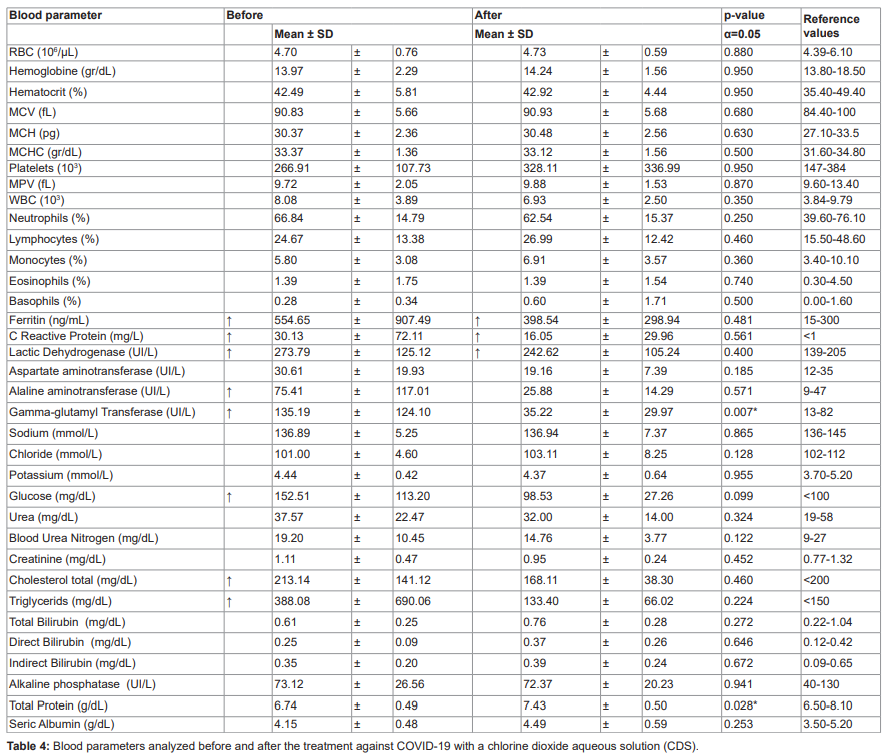
Tous les paramètres de l’hémogramme étaient dans les limites de la normale avant et après le traitement au ClO2. Tous les patients pour lesquels des métabolites sanguins étaient disponibles ont commencé le traitement avec des taux élevés de ferritine, de protéine C-réactive, de lactate déshydrogénase, d’alanine aminotransférase, de gamma-glutamyltransférase, de glucose, de cholestérol total et de triglycérides.
Après consommation deClO2, la plupart de ces paramètres sont revenus à des valeurs physiologiques normales. Les exceptions sont la ferritine sérique, la protéine C-réactive et la lactate déshydrogénase, qui ont diminué mais n’ont pas atteint des niveaux normaux pendant la durée de l’étude. (Tableau 4).
Les jours pour atteindre le 90% de SpO2 ne diffère pas entre les patients ayant reçu un supplément d’oxygène et ceux qui n’en ont pas reçu (IC 95 % : 7,53-9,47 jours, P=1,00) ; cependant, il a fallu aux patients ayant reçu un supplément d’oxygène près de cinq jours de moins pour atteindre uneSpO2 de 95% par rapport à ceux qui ne l’ont pas utilisé (IC 95 % : 12,53-14,47 jours vs. 18,52-20,48 jours, P=0,004).
La supplémentation en oxygène a diminué à un taux de -2,45*ln (durée du traitement). (Figure 2b). En outre, la durée et la quantité d’oxygène administrée différaient selon la gravité (Kruskal-Wallis, x^2=9,6382, df=2, P=0,008 ; x^2=16,89, df=2, P=0,002 ; respectivement).
Tous les paramètres de la formule sanguine complète se situaient dans les limites de la normale avant et après le traitement au ClO2. Tous les patients pour lesquels des métabolites sanguins étaient disponibles ont commencé le traitement avec des taux élevés de ferritine, de protéine C-réactive, de lactate déshydrogénase, d’alanine aminotransférase, de gamma-glutamyltransférase, de glucose, de cholestérol total et de triglycérides.
Après consommation de ClO2, la plupart de ces paramètres sont revenus à des valeurs physiologiques normales. Les exceptions sont la ferritine sérique, la protéine C-réactive et la lactate déshydrogénase, qui ont diminué mais n’ont pas atteint des niveaux normaux pendant la durée de l’étude.(Tableau 4).
Discussion Cette étude rétrospective a recueilli les données de 1136 personnes ayant utilisé un CDS comme traitement pour le COVID-19.
Nous avons constaté que leClO2 est un traitement sûr et efficace pour les patients atteints de COVID-19, qui, quelle que soit la gravité, réduit les symptômes chez les patients atteints de COVID-19. 99.03% de cas.
Les comorbidités, l’âge et le sexe ont été associés à la gravité de la COVID-19 présentée par les patients (annexe 1). Parce que l’effet du ClO2 dépend non seulement de leur concentration mais aussi du temps de contact. [19], Les patients ont été traités par un CDS selon différents protocoles (dose et intervalles de prise variables) en fonction de la gravité de la maladie, avec une dose moyenne de 1,41 mg/kg par jour (intervalle de 0,67 à 5,40 mg/kg/jour). En outre, neuf patients ont déclaré s’être gargarisés avec 0,015 % de CDS.
Il a été proposé de désinfecter la bouche et l’oropharynx par des rinçages réguliers avec une solution microbienne telle que la povidone iodée. [29] ou du CDS [17,19,30] pour réduire de manière significative la charge virale dans la bouche et les voies respiratoires supérieures.
Les doses de traitement utilisées dans cette étude rétrospective se situaient dans les limites de sécurité rapportées pour l’usage humain. [7,31,32]. En outre, les doses utilisées étaient inférieures à la « dose minimale avec effet nocif observé » (LOAEL), soit huit fois moins que les doses auxquelles des effets nocifs se produisent et au moins 30 fois moins que la dose létale 50 (DL50=94 mg/kg ; Organisation mondiale de la santé, 2002).
La prise orale de ClO2 à des concentrations de 5 mg/L pendant 12 semaines n’a pas démontré d’effets nocifs chez l’homme. [7,31]. Récemment, il a été démontré qu’à une dose de 0,6 mg/kg, le ClO2a un potentiel prophylactique contre COVID-19 sans provoquer d’effets négatifs modérés ou graves chez la plupart des patients ; chez ceux qui ont signalé des effets secondaires (1,12 %), les symptômes étaient légers et sporadiques. [33,34].
En outre, il a été démontré que leClO2est un antimicrobien sélectif en fonction de la taille et, à des concentrations appropriées, il peut être utilisé chez les animaux et les humains en raison de son incapacité à pénétrer dans les tissus.[16,18,19].
Par rapport à d’autres médicaments, les patients de COVID-19 qui ont pris ClO2 ont bénéficié d’un temps de récupération plus court que celui observé pour d’autres traitements. Il est important de garder à l’esprit que la durée des symptômes chez les patients traités exclusivement avec le ClO2 était inférieure de moitié à celle des patients traités par plusieurs médicaments (3,26 jours contre 8,15 jours, respectivement).
L’utilisation simultanée de plusieurs médicaments a été associée à une augmentation de la mortalité chez les patients COVID-19 de sexe masculin et à des taux plus élevés de lésions rénales aiguës et de réactions indésirables aux médicaments. [35].
Il est recommandé de concevoir des essais cliniques avec un suivi détaillé afin d’évaluer l’effet du dioxyde de chlore sur le temps de récupération et ses interactions avec d’autres médicaments.
Dans cette étude, 6,78 % des personnes interrogées ont signalé des effets secondaires transitoires légers après l’ingestion de CDS, notamment des maux de tête, des diarrhées, des gastrites et des vertiges, ce qui est similaire à ce qui avait été rapporté dans une étude précédente. [34]. Chez ces 77 patients, la dose a été réduite de moitié immédiatement après l’apparition des symptômes. Par la suite, une augmentation progressive a été effectuée jusqu’à ce que la dose de traitement soit atteinte.
Après cet ajustement, aucun patient n’a de nouveau signalé d’effets indésirables. Les patients traités par CDS intraveineux n’ont signalé aucun effet secondaire. Nos résultats montrent que le ClO2 à la dose utilisée est sûr et n’a pas d’effets secondaires graves, même s’il est utilisé à des doses plus élevées. Les analyses sanguines corroborent également l’absence d’effets indésirables, la plupart des paramètres mesurés se situant dans la fourchette normale après le traitement.
La ferritine, la protéine C-réactive et la lactate déshydrogénase étaient supérieures aux limites standard. Cependant, ces analytes étaient plus faibles qu’au début de la maladie. En outre, les enzymes hépatiques, le glucose, le cholestérol total et les triglycérides étaient plus faibles à la fin du traitement.
Le pourcentage de patients traités par CDS qui sont sortis de l’hôpital (99,03 %) est plus élevé que celui rapporté dans d’autres études (allant de 85 % à 92,3 % ; Beigel 2020 ; Heras 2021 ; Rajter 2021). En ce sens, notre étude rétrospective justifie la réalisation d’études de cohortes prospectives ou d’essais contrôlés randomisés en aveugle afin de comparer de manière adéquate l’effet du ClO2 avec celle d’autres médicaments.
En raison du peu de données publiées sur le ClO2 comme traitement alternatif chez l’homme, la réalisation de telles études dans un cadre contrôlé est urgente, pertinente et nécessaire, d’autant plus que dans notre étude, la durée moyenne des symptômes chez les patients traités avec le ClO2 était de 4,84 jours, soit près de 9 jours de moins que la moyenne nationale. [36-38], et plus de 20 jours de moins que la durée moyenne de rétablissement des patients en Inde, un pays dont les conditions socio-économiques et la structure démographique sont similaires à celles du Mexique.[39]. De plus, 92,01% des patients de notre étude ont été guéris avant le 10ème jour de traitement, alors que dans l’étude mentionnée ci-dessus, seuls 4% ont été guéris dans le même délai.
La durée de rétablissement était également plus courte que celle des patients en Belgique, à Hong Kong et au Royaume-Uni, où ils ont été hospitalisés pendant 5,9 jours, 4,41 jours et 5,14 jours, respectivement.[40,41]; Au Canada et au Brésil, le délai de récupération est proche de 14 jours, tandis qu’au Japon, le délai moyen est inférieur à 14 jours. [38]. Une vaste méta-analyse (incluant 25 pays) a révélé que le temps de récupération chez les patients atteints de COVID-19 variait de 5 à 29 jours [6].Le ClO2 pourrait réduire de manière significative la durée des symptômes chez les patients atteints de COVID-19, même chez ceux qui présentent des symptômes sévères.
Les patients ont commencé le traitement avec une moyenne de SpO2 de 86,05 %, un état connu sous le nom d’hypoxie sévère. [23]; 129 patients ont reçu en moyenne 5,77 litres d’oxygène par minute pendant 4,32 jours. Après une semaine de consommation deClO2, 90 % des patients présentaient une hypoxie modérée. (SpO2 entre 90% et 94%), et deux semaines plus tard, les patients ne souffraient plus d’hypoxie.
Il est intéressant de noter que le seuil de 90 % de SpO2 a été atteint chez les patients avec ou sans supplément d’oxygène au cours des sept premiers jours de traitement. Cependant, les patients gravement malades qui n’ont pas reçu de supplément d’oxygène ont mis près de cinq jours de plus pour atteindre un état d’oxygénation SpO2 plus de 95 % de plus que ceux qui ne l’ont pas utilisé.
Dès la première prise de CDS, on a constaté une augmentation du taux d’oxygène dans le sang des patients, ce qui améliore la réponse physiologique et réduit l’anxiété du patient face à l’hypoxie. [42]; Cependant, la supplémentation en oxygène était essentielle, principalement chez les patients atteints d’une maladie grave, car elle permettait d’accélérer le rétablissement des malades. D’autres études devraient être menées pour comprendre le mécanisme par lequel la Le ClO2 améliore la concentration d’oxygène dans le sang.
L’un des principaux avantages du traitement par le ClO2 est que les patients peuvent être traités à domicile sans avoir besoin d’être hospitalisés. Cela permet d’éviter l’apparition d’infections bactériennes ou fongiques courantes dans l’unité de soins intensifs (40,7 % en moyenne), qui ont été associées de manière significative au décès (OR 2,7, 95 % CI 1,2-5,9, P=0,015). [43-58]. Le traitement à domicile augmente les chances de survie des patients et évite en outre l’effondrement des systèmes de santé, en particulier dans les pays à revenu faible ou intermédiaire [6], comme le Mexique. Le traitement COVID-19 génère des coûts importants dans les hôpitaux publics et est très coûteux dans les hôpitaux privés, de sorte qu’une grande partie de la population n’a pas accès aux soins privés.
Limites: Bien que passionnante, nous sommes conscients que notre étude présente certaines limites. La première est qu’il s’agit d’une étude d’observation rétrospective, ce qui signifie qu’aucune preuve concluante ne peut être établie quant à l’efficacité du ClO2 parce que nous ne pouvions utiliser que les informations contenues dans les dossiers médicaux des patients et que nous n’avions aucun contrôle sur les variables de l’étude. Deuxièmement, il existe un risque de distorsion de l’information car les parents ou les patients fournissent les informations initiales et cliniques. Troisièmement, il était impossible d’établir avec certitude que tous les patients étaient atteints de COVID-19, car les tests de diagnostic n’avaient pas été effectués pour tous les patients.
Cependant, 72,30 % des patients ayant subi un test d’anticorps avaient développé des IgG ou des IgM contre le SAR-CoV-2. Quatrièmement, en raison du manque d’informations supplémentaires, l’interprétation de nos résultats pourrait être au moins partiellement confondue (par exemple, les différences dans les habitudes alimentaires, l’observance correcte du traitement et la qualité dU ClO2). Ces variables, ainsi que d’autres, devraient être prises en compte dans les études futures.
Conclusion
Il s’agit de la première étude à examiner les effets indésirables et les avantages d’une solution de dioxyde de chlore en tant que traitement alternatif du COVID-19. Les effets secondaires liés à la consommation de dioxyde de chlore sont rares : 6,78 % des patients ont signalé des effets secondaires, qui étaient légers, transitoires et ne mettaient pas leur vie en danger.
Les analyses de sang n’ont révélé aucun changement systémique après la consommation de dioxyde de chlore ; en outre, plusieurs paramètres sanguins initialement élevés ont diminué et sont devenus normaux après le traitement au dioxyde de chlore. Dès la première prise, le dioxyde de chlore améliore la concentration d’oxygène dans le sang, ce qui améliore la réponse physiologique.
Les patients traités au dioxyde de chlore seul ont présenté moins de jours de symptômes que ceux traités avec plusieurs médicaments. 99,07% des patients traités sont sortis de l’hôpital sans aucun problème de santé. Nos résultats indiquent que, lorsqu’il est utilisé correctement, le dioxyde de chlore en solution est sans danger pour la consommation humaine à la concentration et au dosage appropriés. Cette étude démontre un haut niveau de sécurité et d’efficacité du dioxyde de chlore dans le traitement du COVID-19.
Ces résultats justifient la réalisation d’essais contrôlés randomisés pour évaluer son efficacité contre le SARS-CoV-2. Un tel essai pourrait ouvrir la voie à d’autres recherches sur l’utilisation potentielle de nouveaux composés pour résoudre des problèmes de santé publique actuels et futurs, ce qui est, après tout, l’objectif de l’Organisation mondiale de la santé et d’autres autorités sanitaires.