CDS Chemie
Chlordioxid ist eine anorganische Verbindung, die aus dem Element Chlor (Cl) und Sauerstoff (O) besteht. Seine chemische Formel lautet ClO₂. Es ist ein gelb-grünliches Gas. Es kommt in der Umwelt nicht natürlich vor. Bei der Reaktion zwischen Natriumchlorit und Salzsäure bilden sich Chlordioxid, Kochsalz und Wasser.
5 NaClO2 + 4 HCl → 4ClO2 + 5 NaCl + 2 H2O
Es gibt noch andere Formen der Herstellung, die hier jedoch nicht von Bedeutung sind.
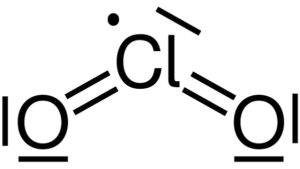
Lewis-Struktur des Chlordioxids ClO₂. Yikrazuul [Public domain]. Quelle: Wikimedia Commons.
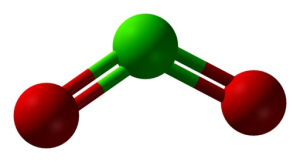
Struktur von ClO₂ in drei Dimensionen. Grün=Chlor; rot=Sauerstoff. Ben Mills und Jynto [gemeinfrei]. Quelle: Wikimedia Commons.
Es ist wichtig, zwischen den Eigenschaften von Chlordioxid als Gas und als wässrige Lösung zu unterscheiden:
Eigenschaften als Gas:
Link: https://gestis-database.dguv.de/data?name=001640
– Aggregatzustand: Gas, gelblich-grün bis gelblich-rot gefärbt.
– Molekulargewicht: 67,45 g/mol.
– Schmelzpunkt: -59 °C.
– Siedepunkt: 11 °C.
– Redoxpotential (ORP): 0,94V.
– Dichte: 1,642 g/cm3 @ Temp: 0 °C, Gas = 2,33 (relative Dichte zu Luft, Luft=1).
– Dampfdruck: 140 kPa bei 20 °C.
– Kritische Temperatur: 192 °C.
– ClO₂ hat ein Molekulargewicht von 67,46 und eine Standardoxidationsstufe von +4 für die Cl-Atome.
– ClO₂ hat einen Siedepunkt von 11 °C, einen Schmelzpunkt von -59 °C, eine Dichte von 1,64 g/mL (Flüssigkeit) bei 0 °C, eine Wasserlöslichkeit von 3,0 g/L bei 25 °C und einen pKa-Wert von 3,0.
– Es ist sehr löslich in Wasser und hydrolysiert nicht.
– Es riecht ähnlich wie Chlor und ist giftig, wenn es über einen längeren Zeitraum in großen Mengen eingeatmet wird.
– Es ist in Wasser löslich, sehr löslich und hydrolysiert nicht.
– Konzentrierte ClO2-Dämpfe sind potenziell explosiv, insbesondere wenn sie in der Luft eine Konzentration von mehr als 10 % haben.
– Sie sollten nicht komprimiert werden, ob allein oder in Verbindung mit anderen Gasen, aufgrund des Risikos einer Explosionskompression oder durch den Effekt von UV-Sonnenlicht.
– ClO2 als Gas zersetzt sich sofort bei Kontakt mit organischen Materialien.
– Es kann auch in Gegenwart von Quecksilber (Hg) oder Kohlenmonoxid (CO) reagieren.
– Unter Einwirkung von ultraviolettem Licht (UV) oder Ozon wird ClO2 zu Chlortrioxid (Cl2O6), einem sehr instabilen Verbindung.
Eigenschaften von Chlordioxid in wässrigen Lösungen:
Link: https://gestis-database.dguv.de/data?name=531775
– Es wird als Lebensmittelzusatzstoff E-926 klassifiziert.
– Löslichkeit in Wasser: Konzentration: 3 g/l – Partialdruck: 4,6 kPa – Temperatur: 25 °C.
– Aggregatzustand: Gas, in Wasser gelöst (CDS).
– Die wässrigen Lösungen von Chlordioxid sind grünlich-gelb in Wasser, und ihr Grad zeigt ihre Konzentration an.
– In wässriger Lösung ist Chlordioxid hoch löslich und hydrolysiert nicht, um andere Moleküle mit dem Wasserstoff des Wassers zu bilden.
– Sie sind stabil, wenn sie gut verschlossen in einer braunen Glasflasche aufbewahrt werden.
– CDS diffundiert durch Kunststoffe aufgrund seiner kleinen Größe von etwa 140 Pikometern.
– Der CDS-Konzentrat sollte kühl und gut verschlossen vor Sonnenlicht geschützt aufbewahrt werden.
– In Gegenwart von Licht zersetzt es sich langsam und bildet Salzsäure (HCl) und Chlorsäure (HClO3), wodurch der pH-Wert der Lösung sinkt.
– In alkalischen Lösungen zersetzt sich ClO2 zu Chlorit-Ionen (ClO2-) und in sehr alkalischen Lösungen, pH-Wert über 10, zu Chlorat (ClO3-).
– In sauren Lösungen bildet sich Chlorige Säure (HClO2) und zersetzt sich dann zu Salzsäure (HCl) und Chlorsäure (HClO3).
– Das UV-Absorptionsspektrum von ClO₂-Lösungen zeigt ein breites Band mit einem Peak bei 360 nm und einer molaren Extinktionskoeffizienten von ~1250 M-1 cm-1.
– Es ist wichtig, zwischen der Mischung von Natriumchlorit mit einer Säure und dem allein gelösten Gas zu unterscheiden, da sie sich unterschiedlich verhalten. Die Mischung erzeugt eine kontinuierlich oszillierende Reaktion, während das in Wasser gelöste Gas stabil ist und als CDS bekannt ist. Die Mischung hat ein Redoxpotential von +5, während das in Wasser gelöste Gas ein Redoxpotential von +4 hat und nicht mit HCl reagiert.
– Es wird zur Wasseraufbereitung verwendet, um es sicher zum Trinken zu machen, da es gegen Viren, Bakterien und Pilze wirksam ist.
Medizinische Anwendungen:
– Wässrige Lösungen von ClO2 wurden zur Behandlung von oralen Candidiasis (Mundinfektion) eingesetzt. Candidiasis ist eine Infektion durch den Pilz Candida albicans. Chlordioxid beseitigt den Pilz im Mund und verbessert das Aussehen des Mundgewebes signifikant ohne Nebenwirkungen.
– ClO2-Lösungen, die auf Operationswunden aufgetragen werden, können die Bildung von Adhäsionen verringern oder unterdrücken, ohne die Heilung zu beeinträchtigen, mit dem zusätzlichen Vorteil ihrer antiseptischen Eigenschaften.
– Es wurde erfolgreich zur Desinfektion von Blutspendenbeuteln gegen virale Kontamination im Jahr 1993 (Alcide) verwendet.
– Es wurde erfolgreich gegen das Sars-cov-2-Coronavirus eingesetzt, nachdem ein entsprechendes Gesetz in Bolivien und vielen anderen Ländern erlassen wurde.
– Aufgrund von Beweisen für seine klinische Wirksamkeit gibt es viele neue medizinische Forschungen dazu in Bearbeitung.
– Die Absorption aus einer wässrigen Lösung von ClO₂ erfolgt schnell innerhalb von 7-15 Minuten. Das aufgenommene chemische Mittel ist wahrscheinlich das ClO₂ Gas welches nach dem Fickschen Gas-difusionsgesetz durch die Magenwand aufgenommen wird. Es reagiert nicht mit dem HCl der Magensäure.

